(5分)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A 萃取分液 B 蒸发结晶 C.分液 D.蒸馏 E、过滤
(1) 分离饱和食盐水和沙子的混合物。
(2) 分离水和汽油的混合物。
(3) 分离CCl4(沸点为76.75○C)和甲苯(沸点为110.6○C)的混合物。
(4) 将碘从碘水中提取出来。
(5) 从硫酸钾溶液中得到硫酸钾固体。
在下图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,F在D中燃烧发出苍白色火焰。H可用于制造光导纤维,J是一种乳白色凝胶状沉淀。(部分生成物和部分反应条件未列出)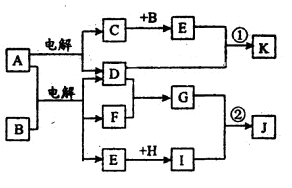
请回答下列问题:
(1)A的电子式为
形成单质D的元素在周期表中的位置
(2)形成C、D、F单质的元素半径由大到小的顺序(填写元素符号)
(3)C长期暴露在空气中,最终产物是
(4)H的化学式为H在高温下与碳反应,若转移4mol电子参加反应的碳为mol。
(5)写出反应①的离子方程式
(6)写出反应②的化学方程式
二甲醚是—种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的气化的主要化学反应方程式为_______________________________________。
(2)煤的气化过程中产生的有害气体用溶液吸收,生成两种酸式盐,该反应的
化学方程式为__________________________________________________________。
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g);△H=-90.8kJ·mol-1
CH3OH(g);△H=-90.8kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g);△H=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g);△H=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g);△H=-41.3kJ·mol-1
CO2(g)+H2(g);△H=-41.3kJ·mol-1
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H=;
CH3OCH3(g)+CO2(g)的△H=;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是
________________(填字母代号)。
a.高温b.加入催化剂c.减少CO2的浓度d.增加CO的浓度e.分离出二甲醚
(4)已知反应②2CH3OH(g)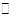 CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。
此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol•L) |
0.44 |
0.6 |
0.6 |
①比时正、逆反应速率的大小: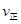 _______
_______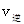 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②若加入CH3OH后,经l0min反应达到平衡,此时c(CH3OH)=__________;该时
间内反应速率v(CH3OH)=__________________。
某芳香族化合物A的分子中含有C、H、 O、N四种元素,相同状况下,其蒸气的密度氢气密度的68.5倍。现以苯为原料合成A,并最终制得F(一种染料中间体),转化关系如下: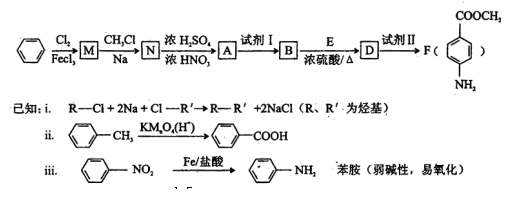
请回答下列问题:
(1)写出A的分子式_______________;A的结构简式_____________________。
(2)N-A的反应类型是__________________。
(3)①上述转化中试剂I和试剂II分别是:试剂I_________,试剂II__________(选填字母)。
a.KMnO4(H+) b.Fe/盐酸 c.NaOH溶液
②若上述转化中物质A依次与试剂Ⅱ、试剂I、化合物E(浓硫酸/△)作用,能否得到F,为什么?______________________________________________________________。
(4)用核磁共振氢谱可以证明化合物E中含有________种处于不同化学环境的氢。
(5)写出同时符合下列要求的两种D的同分异构体的结构简式_________________。
①嘱于芳香族化合物,分子中有两个互为对位的取代基,其中—个取代基是硝基;
②分子中含有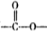 结构。
结构。
(6)有一种D的同分异构体W,在酸性条件下水解后,可得到一种能与溶液发生显
色反应的产物,写出W在酸性条件下水解的化学方程式_________________________。
(7)F的水解反应如下: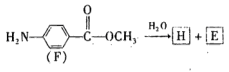
化合物H在一定条件下经缩聚反应可制得高分子纤维,广泛用于通讯、导弹、宇航等领域。请写出该缩聚反应的化学方程式____________________________________________。
有原子序数依次增大的A、B、C、D、E、F六种短周期元素;A元素的原子半径是所有元素中原子最小的;C元素的最高价氧化物对应水化物与其氢化物能生成盐M;E与A同主族,且与E同周期;F元素原子的最外层电子数比次外层电子数少2;A、B、C、E、F这五种元素,每—种与D元素都能形成原子个数比不相同的若干种化合物。请回答:
(1)D元素在周期表中的位置为______________。
(2)可以比较D和F得电子能力强弱的是___________________(填写编号)。
a.比较这两种元素原子半径的大小
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(3)盐M中含有的化学键类型有______________________;并写出其中阳离子的电子式_________________。
(4)已知1molE与水反应放出283.5kJ的热量,试写出E与水反应的热化学反应方程式
________________________________________________________________。
(5)固体氧化物燃料电池(SOFC)以固体氧化物作为电解质。其工作原理如下图所示。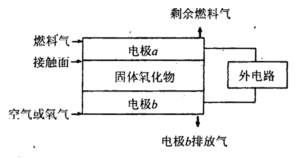
①固体氧化物中的O2-向_________(填“正”或“负”)极移动。
②电极b为电池_________极,其电极反应式为______________________________。
③若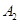 作为燃料气,则接触面上发生的反应为______________________________。
作为燃料气,则接触面上发生的反应为______________________________。
④若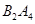 作为燃料气,则接触面上发生的反应为________________________________。
作为燃料气,则接触面上发生的反应为________________________________。
有机物A是一种军用催泪弹的主要有效成分。经分析A的相对分子质量为161,除含有C、H元素外,它还含有一种卤族元素,且分子中只含有一个甲基。化合物A~F的转化关系如下图所示,其中足量的新制Cu(OH)2悬浊液与1mol C反应可生成1mol Cu2O 和1mol D,B1和B2均为较稳定的化合物且互为同分异构体。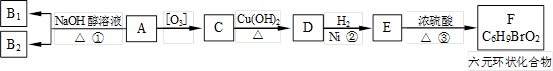
已知:①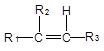
 +
+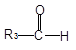
②一个碳原子上连有两个碳碳双键的结构(—C=C=C—)不稳定。
请完成下列问题;
(1)化合物A含有的官能团是。B1的相对分子质量是。
(2)①、②、③的反应类型分别是。
(3)写出A、F的结构简式:
A.;F.。
(4)写出C→D反应的化学方程式:
。
(5)符合下列条件的C的同分异构体共有________种。
①含有二个甲基;②含有二个醛基。