“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如下图所示。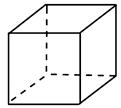
(1)“立方烷”的分子式为____________________________________。
(2)该立方烷的二氯代物具有同分异构体的数目是________。
在4L体积不变的密闭 容器中充入6molA气体和5molB气体,发生反应:
容器中充入6molA气体和5molB气体,发生反应:
3A (g) + B (g) 2C (g) + x D (g), 2分钟后反应达到平衡,生成了2molC,经测定D的浓度为0.25mol·L-1, 求:
2C (g) + x D (g), 2分钟后反应达到平衡,生成了2molC,经测定D的浓度为0.25mol·L-1, 求:
(1) x= 。
(2) 用B表示的2分钟内的平均反应速率______________________。
(3)达到平衡时 ,在相同温度下容器内混合气体的压强与反应前压强比为。
,在相同温度下容器内混合气体的压强与反应前压强比为。
(4)达到平衡状态时B的转化率为。
右下图是以Zn和Cu为电极,稀硫 酸为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
酸为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
| Date:2011.03.06 实验后的记录: ①Zn为阳极,Cu为阴极 ②H+向负极移动 ③电子流动方向Zn→Cu ④Cu极有H2产生 ⑤若有1mol电子流过导线,则产生H2为0.5mol。 ⑥正极的电极反应式:Zn-2e- =Zn2+ |
(1)在卡片上,叙述合理的是__________________(填序号)。
(2)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是__ __________________________________________________。
__________________________________________________。
(3)如果把锌片换成石墨,发现电流计指针几乎不能偏转,原因________________。
(4)如果把硫酸换成硫酸铜溶液,猜测_________(填“锌极”或“铜极”)变粗,原因是__________________(用电极方程式表示)。
A、B、C、D、E 是五种短周期元素,原子序数依次增大。前四种的原子序数之和是E的原子序数的二倍。E的阳离子与D的阴离子都比A阳离子多2个电子层。D与四种元素中任意一种都可形成原子个数比不相同的若干种化合物。B是形成化合物种类最多的元素。请回答下列问题:
是五种短周期元素,原子序数依次增大。前四种的原子序数之和是E的原子序数的二倍。E的阳离子与D的阴离子都比A阳离子多2个电子层。D与四种元素中任意一种都可形成原子个数比不相同的若干种化合物。B是形成化合物种类最多的元素。请回答下列问题:
(1)写出元素符号:A________,E________。
(2)D在周期表中位于第_______周期第________族,BD2的结构式为____________.
(3)五种元素原子半径由大到小的顺序是(用A~E字母表示)_______________。
(4)A、B、C、D可形成一种受热易分解的化合物,写出该化合物受热分解的化学方程式____________________________________________________________。
(5)E2D2化合物的电子式为_____________,该化合物中化学键类型有_______________.
(6)用电子式表示A2D的形成过 程_________________________________;
程_________________________________;
下图转化关系中,A、B、C、D、E都是短周期元素的单质,在常温常压下A是固体,其余都是气体,且C呈黄绿色。化合物H和I两种气体相遇时产生白烟。化合物G的焰色反应为黄色。反应①和②均在溶液中进行。
请按要求回答下列问题。
(1)写出下列物质的化学式:D、F ___________。
(2)反应①的离子方程式为 ___________。
___________。
(3)向K溶液中加 入硝酸酸化的硝酸银溶液,反应的现象为 ____________。
入硝酸酸化的硝酸银溶液,反应的现象为 ____________。
(4)将少量单质C通入盛有淀粉KI溶液的试管中,液体变为蓝色。该反应的离子方程式为。这说明单质C的氧化性于单质碘(填“强”或“弱”)。
在1×105Pa和298K时,将拆开1mol共价键 所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能:
所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能:
| 共价键 |
H-H |
N≡N |
N-H |
| 键能(kJ·mol-1) |
436 |
945 |
391 |
(1)根据上表中的数据判断工业合成氨的反应:N2+3H2 2NH3是___________(填“吸热”或“放热”)反应;
2NH3是___________(填“吸热”或“放热”)反应;
(2)在298K时,取1mol氮气和3mol氢气放入一密闭容器中,在催化剂存在下进行反 应,若氮气和氢气完全反应,理论上放出或吸收的热量为Q1,则Q1为__________;
应,若氮气和氢气完全反应,理论上放出或吸收的热量为Q1,则Q1为__________;
(3)实际生产中,放出或吸收的热量为Q2,Q1与Q2比较,正确的是()
A. Q1>Q2 B. Q1<Q 2 C. Q1=Q2
2 C. Q1=Q2
如此选择的理由_________________________________________________;
⑷.哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充人1mol N2和3mol H2,在一定条件下使该反应发生:N2+3H2 2NH3。下列有关说法正确的是_______________________.
2NH3。下列有关说法正确的是_______________________.
A.达 到化学平衡时,正反应和逆反应的速率都为零。
到化学平衡时,正反应和逆反应的速率都为零。
B.当符合:3u正(N2)=u正(H2)时,反应达到平衡状态。
C.达到化学平衡时,单位时间消耗amolN2,同时生成3amolH2
D. k反应达到平衡状态,最多可生成氨2 mol。
E. 工业 合成氨,我们希望提高反应物的转化率并加快反应速率。
合成氨,我们希望提高反应物的转化率并加快反应速率。
F.氨分子内形成氢键,使氨的沸点升高.
G.氮分子的分子间作用力大,使氮分子化学性质很稳定.
H.氢能源属于化石能源.