在4L体积不变的密闭 容器中充入6molA气体和5molB气体,发生反应:
容器中充入6molA气体和5molB气体,发生反应:
3A (g) + B (g)  2C (g) + x D (g), 2分钟后反应达到平衡,生成了2molC,经测定D的浓度为0.25mol·L-1, 求:
2C (g) + x D (g), 2分钟后反应达到平衡,生成了2molC,经测定D的浓度为0.25mol·L-1, 求:
(1) x= 。
(2) 用B表示的2分钟内的平均反应速率______________________。
(3)达到平衡时 ,在相同温度下容器内混合气体的压强与反应前压强比为 。
,在相同温度下容器内混合气体的压强与反应前压强比为 。
(4)达到平衡状态时B的转化率为 。
(16分)化学学科中的平衡理论主要内 容包括:化学平衡、电离平衡、水解平衡和
容包括:化学平衡、电离平衡、水解平衡和
溶解平衡等四种,且均符合勒夏特列原理。请回答下列问题:
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g)  4C(g)△H>0达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(c)
4C(g)△H>0达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(c)
=4mol/L。试确定B的起始浓度c(B)的取值范围是;若改变
条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是。
①增加C的物质的量②加压③升温④使用催化剂
(2)反应C(s)+CO (g)
(g)  2CO(g)平衡常数K的表达式为;
2CO(g)平衡常数K的表达式为;
已知C(s)+H 0(g)t
0(g)t CO(g)+H
CO(g)+H (g)的平衡常数为K1;H
(g)的平衡常数为K1;H (g)+CO
(g)+CO (g)
(g)  C0(g)
C0(g)
+H 0(g)的平衡常数为恐,则K
0(g)的平衡常数为恐,则K 与K
与K 、K
、K 二者的关系为。
二者的关系为。
(3)已知某温度下,反应2SO +0
+0
 2S0
2S0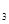 的平衡常数K=19。在该温度下的体积
的平衡常数K=19。在该温度下的体积
固定的密闭容器中,co(SO )=lmol·L
)=lmol·L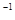 c0(O
c0(O )=1mol·L
)=1mol·L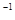 ,当反应在该温度下SO
,当反应在该温度下SO 转化率
转化率
为80%时,该反应(填“是”或“否”)达到化学平衡状态,若未达到,向
(填“正反应”或“逆反应”)方向进行。
(4)对于可逆反应:aA(g)+bB(g)  cC(g)+riD(g)△H=
cC(g)+riD(g)△H= kJ·mol
kJ·mol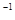 ;若
;若 +b>
+b>
c+d,增大压强平衡向(填“正反应”或“逆反应”)方向移动;若升高温度,平衡向
逆反应方向移动,则 0(填“>”或“<”)。
0(填“>”或“<”)。
(7分)火箭推进器中盛有强还原剂液态胼(N H
H 凰)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256 KJ的热量。
凰)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256 KJ的热量。
(1)反应的热化学方程式为。
(2)又已知H 0(I)=H
0(I)=H 0(g);△H="+44" kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是KJ。
0(g);△H="+44" kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是KJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是。
(4)已知N (g)+2O
(g)+2O (g)=2N0
(g)=2N0 (g)△H=+67.7kJ/mol
(g)△H=+67.7kJ/mol
N H
H (g)+0
(g)+0 (
( g)=N
g)=N (g)+2H
(g)+2H 0(g)△H=-534kJ/mol
0(g)△H=-534kJ/mol
则肼与N0 完全反应生成氮气和液态水的热化学方程式为
完全反应生成氮气和液态水的热化学方程式为
(10分)常温下,向100mL0.01mol·L HA溶液中逐滴加入0.02mol
HA溶液中逐滴加入0.02mol MOH溶液,图中所示曲线表示混合溶液的pH变化情况体积变化忽略不计)
MOH溶液,图中所示曲线表示混合溶液的pH变化情况体积变化忽略不计) 。回答下列问题:
。回答下列问题: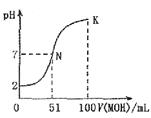
(1)由图中信息可知HA为酸(填“强”或 “弱”),理由是。
(2)常温下一定浓度的MA稀溶液的pH= ,则
,则 7(填“>”、“<”或“=”),用离子方程式表示其原因为,此时,溶液中由水电离出的c(OH
7(填“>”、“<”或“=”),用离子方程式表示其原因为,此时,溶液中由水电离出的c(OH )=。
)=。
(3)请写出K点所对应的溶液中离子浓度的大小关系:。
(4)K点对应的溶液中,c(M )+c(MOH)2c(A
)+c(MOH)2c(A )(填“>”、“<”或“=”);若此时溶液中,pH=lO,则c(MOH)+c(OH
)(填“>”、“<”或“=”);若此时溶液中,pH=lO,则c(MOH)+c(OH )=mol·L
)=mol·L 。(用代数式表示)
。(用代数式表示)
(8分)用:NaCl做原料可以得到多种产品。
(1)工业上由NaCI制备金属钠的化学方程式是。
(2)实验室用惰性电极电解100mL 0.1mol/LNaCl溶液。写出阳极的电极反应方程式:
。
(3)某学生想制作一种家用环保型消毒液发生器,用石墨做电极电解饱和NaCl溶液。为使Cl 被完全吸收,制得有较强杀菌能力的消毒液(“84消毒液”),设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
被完全吸收,制得有较强杀菌能力的消毒液(“84消毒液”),设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
| A.a为正极,b为负极;NaClO和NaCl |
| B.a为负极,b为正极;NaClO和NaCl |
| C.a为阳极,b为阴极;HClO和NaCl |
| D.a为阴极'b为阳极;HClO和NaCl |
假设最后所得溶液中仅含一种溶质,则整个过程用一个化学方程式表示为:
。
(5分)已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl 溶液、Fe
溶液、Fe (SO
(SO )
) 溶液、盐酸。按要求回答下列问题:若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池?(填“能”或“不能”)。若能,请写出电极反应式:负极,正极。若不能,请说明原因。
溶液、盐酸。按要求回答下列问题:若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池?(填“能”或“不能”)。若能,请写出电极反应式:负极,正极。若不能,请说明原因。