(9分)某实验需要200mL、0.1mol/L的Na2CO3溶液,现通过如下操作配制:
①把称量好的 g固体Na2CO3放入小烧杯中,加适量蒸馏水溶解。为加快溶解可以使用________(填仪器名称)搅拌;②把①所得溶液冷却到室温后,小心转入________(填仪器名称);③继续加蒸馏水至液面至刻度线1~2cm处,改用________(填仪器名称)小心滴加蒸馏水至溶液凹液面最低点与刻度线相切;④用少量蒸馏水洗涤玻璃棒和烧杯2~3次,每次洗涤的溶液都小心转入容量瓶,并轻轻摇匀;⑤将容量瓶塞紧,充分摇匀。
(1)操作步骤正确的顺序是________(填序号)。
(2)若没有操作④,则所配溶液的浓度会________(填“偏高”或“偏低”)。
(3)若所配溶液的密度为1.06g/mL,则该溶液的质量分数为________。
(4)若取出20mL配好的Na2CO3溶液,加蒸馏水稀释成c(Na+)=0.01mol/L的溶液,则稀释后溶液的体积为________mL。
(5)在配制100mL、0.1mol/L的Na2CO3溶液时,下列操作中的________会导致结果偏低(请用序号填写)。
①用托盘天平称量时砝码放在左盘
②将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外
③定容时俯视刻度线
④定容时仰视刻度线
⑤干净的容量瓶未经干燥就用于配制溶液
乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。
请回答下列问题。
(1)乙烯的电子式____________,结构简式____________。
(2)甲烷中混有乙烯,欲除乙烯得到纯净的甲烷,可依次将其通过下列哪试些剂的洗气瓶( )
| A.澄清石灰水,浓H2SO4 | B.溴水,浓H2SO4 |
| C.酸性高锰酸钾溶液,浓H2SO4 | D.浓H2SO4,酸性高锰酸钾溶液 |
(3)写出乙烯与溴水的反应_____________________,反应类型为_________反应。
元素的电负性的大小可以作为判断元素金属性与非金属性强弱的尺度。下表列出部分短周期元素的电负性。请回答下列问题。
| 元素 |
Al |
B |
Be |
C |
Cl |
X |
Li |
| 电负性 |
1.5 |
2.0 |
1.5 |
2.5 |
3.0 |
4.0 |
1.0 |
| 元素 |
Mg |
N |
Y |
O |
P |
S |
Si |
| 电负性 |
1.2 |
3.0 |
0.9 |
3.5 |
2.1 |
2.5 |
1.8 |
(1)根据上表给出的数据,可知元素的电负性越大,____(填“金属性”或“非金属性”)越强。
(2)推测Y 为____(填元素符号),用电子式表示X元素与Y元素的化合物的形成过程____________。
某氮肥厂氨氮废水中氮元素多以NH4+和NH3·H2O的形式存在,该废水的处理流程如下:
(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30 ℃,通空气将氨赶出并回收。用离子方程式表示加NaOH溶液的作用:。
(2)过程Ⅱ:在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如右:第一步反应是反应(选填“放热”或“吸热”),1molNH4+(aq)完全转化成NO3-(aq)共与环境交换了 __________kJ热量。
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32g CH3OH转移6 mol电子,则生成的N2物质的量是。
下列物质中:
(1)互为同分异构体的有;(2)互为同素异形体的有;
(3)互为同位素的有;(4)互为同系物的有___________。(填序号)
①石墨②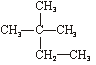 ③C60④CH4⑤
③C60④CH4⑤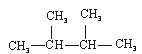 ⑥
⑥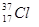 ⑦
⑦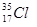 ⑧金刚石⑨C3H6⑩C4H10
⑧金刚石⑨C3H6⑩C4H10
下图是元素周期表中一部分
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
(1)④、⑤、⑥的原子半径由大到小的顺序为(填元素符号)
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式)
(3)①、④、⑤中的元素可形成既含离子键又含极性共价键的化合物,写出化合物的电子式为,由表中②、④两种元素的原子按1:2组成的化合物的结构式为_________________。