将1.00 mol二氧化硫和1.00 mol氧气通入1.00 L的密闭容器中,分别在500 K,600 K,700 K三个不同的温度下进行2SO2+O2 2SO3反应,反应过程中SO3浓度随时间的变化如下面表格所示:
2SO3反应,反应过程中SO3浓度随时间的变化如下面表格所示:
表一:500 K
| 时间(min) |
0 |
5 |
10 |
15 |
20 |
25 |
| SO3浓度(mol·L-1) |
0 |
0.10 |
0.15 |
0.20 |
0.25 |
0.30 |
| 时间 |
30 |
35 |
40 |
45 |
50 |
55 |
| SO3浓度(mol·L-1) |
0.35 |
0.40 |
0.50 |
0.55 |
0.60 |
0.60 |
表二:600 K
| 时间(min) |
0 |
5 |
10 |
15 |
20 |
25 |
| SO3浓度(mol·L-1) |
0 |
0.20 |
0.30 |
0.40 |
0.50 |
0.50 |
表三:700 K
| 时间(min) |
0 |
5 |
10 |
15 |
20 |
25 |
| SO3浓度(mol·L-1) |
0 |
0.25 |
0.35 |
0.35 |
0.35 |
0.35 |
(1)从上面三个表的数据可以判断该反应是__________反应(填“吸热”或“放热”),利用表一计算0~40 min内用SO2表示该反应的化学反应速率v(SO2)=__________mol·L-1·min-1。
(2)对该反应,下面的说法正确的是__________。
A.当容器中的压强不再变化时,该反应就达到平衡
B.达到平衡时v正(SO2)=v逆(SO3)
C.平衡时c(SO2)=c(SO3)
D.当由500 K平衡状态时升高温度至600 K时,重新达到平衡状态时,容器的压强减小
(3)从上面三个表的数据,温度对该反应的反应速率和平衡移动的影响是___________________。
(4)计算在600 K时的平衡常数_______(写出计算过程,最后结果取两位有效数字)。
(5)下图曲线(Ⅰ)是在500 K时SO3浓度的变化曲线,请你在图中画出在550 K进行上述反应的曲线,并标明曲线(Ⅱ)。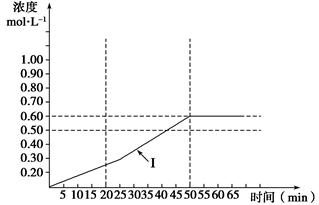
将3.22 g芒硝(Na2SO4·10H2O)溶于水中,要使每100个水分子中溶有1个Na+,则需水的质量为_________g。
某工厂采用含硫酸的氢氟酸溶液作为矿物中稀有元素的提取液。生产要求该提取液中硫酸的浓度为3mol.L-1,氢氟酸的浓度为8mol.L-1。现有一批回收酸液共400 L,经测定其中氢氟酸浓度为12 mol·L-1,硫酸的浓度为l mol·L-1。现要用此回收酸液配制上述提取液,400 L回收酸液经稀释可以得到________L 8 mol·L-1的氢氟酸,在400 L回收酸液中加入________L密度为1.84 g·cm-3、浓度为98%的浓H2SO4,然后________ ,即可得到符合要求的提取液。
在标准状况下,用以下气体做喷泉实验,请根据情况填写烧瓶中溶液的物质的量浓度(假设溶质不扩散)。
(1)用氯化氢气体,喷泉结束后,水充满烧瓶,则溶液的物质的量浓度是_________。
(2)用混有空气的氨气,喷泉结束后,水充至烧瓶容积的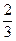 处,则溶液的物质的量浓度是_________。
处,则溶液的物质的量浓度是_________。
有一质量为W g相对分子质量为b的某种碱M(OH)2,在一定温度下完全溶解为V mL的饱和溶液,若溶液的密度为ρ g·cm-3,则溶液的物质的量浓度为__________mol·L-1,溶质质量分数为__________,该碱在此温度下的溶解度为_________g。
200 mL 0.2 mol·L-1和100 mL 0.5 mol·L-1的两种盐酸混合,设得到300 mL盐酸,其物质的量浓度是________。若所得盐酸的密度为1.004 g·cm-3,则其溶质的质量分数是____。