甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
①:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
②:CO(g)+2H2(g)===CH3OH(g) ΔH=-129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为_______________。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室中,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如右图。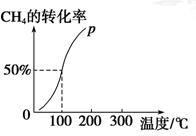
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平衡反应速率为________________。
②100 ℃时反应Ⅰ的平衡常数为__________________。
(3)在压强为0.1 MPa、温度为300 ℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
| A.c(H2)减小 | B.正反应速率加快,逆反应速率减慢 |
| C.CH3OH的物质的量增加 | D.重新平衡c(H2)/c(CH3OH)减小 |
E.平衡常数K增大
【化学—物质结构与性质】
第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物。
(1)Cr的核外电子排布式为;
(2)科学家通过X射线测得胆矾结构示意图可简单表示如下: 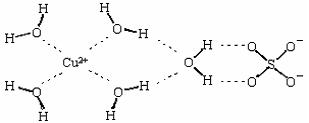
图中虚线表示的作用力为;
(3)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在Cu(NH3)4SO4·H2O晶体中,[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团是,其中心原子的杂化轨道类型是;
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。试推测四羰基镍的晶体类型是 , Ni(CO)4易溶于下列 。
| A.水 | B.四氯化碳 | C.苯 | D.硫酸镍溶液 |
【化学—化学与技术】
硫酸工业生产应考虑综合经济效益问题。
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在的郊区(填标号);
A.有丰富黄铁矿资源的城市 B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市 D.人口稠密的文化、商业中心城市
(2)CuFeS2 是黄铁矿的另一成分,煅烧时CuFeS2 转化为CuO、Fe2O3和SO2,该反应的化学方程式为。
(3)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是。
A.黄铁矿燃烧前需要粉碎,因为大块的黄铁矿不能在空气中燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
| 沸腾炉温度/℃ |
600 |
620 |
640 |
660 |
| 炉渣中CuSO4的质量分数/% |
9.3 |
9.2 |
9.0 |
8.4 |
已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4 的质量分数随温度升高而降低的原因。
(1)某化学兴趣小组的同学进行Cl2、NH3的制备、性质等实验的流程和部分装置如下:

①请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2 的氧化性强弱为Cl2>Fe3+>I2(实验中不断小心振荡G装置中的试管)。请回答A中发生反应的离子方程式,试剂M为溶液,证明氧化性为Cl2>Fe3+>I2的 实验现象是;
②已知3Cl2 +2 NH3 =" 6HCl" + N2 ,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b ,D中的现象为,反应一段时间后,关闭b打开c,观察到的现象为;
③为使实验顺利进行,请简述F中的分液漏斗的正确操作方法 ;
(2)某废水中含有一定量的Na+、SO32-,可能含有CO32-,某研究小组欲测定其中SO32-离子的浓度,设计如下实验方案:
①从下列试剂中选择试剂x为 (填序号):
A.0.1 mol·L-1 KMnO4(H2SO4酸化)溶液 B.0.5 mol·L-1 1NaOH溶液
C.新制氯水 D.KI溶液
②加入试剂x生成SO42-的离子方程式为 ;
③第ⅲ步的“系列操作”包含的操作名称为 、 、 ;
④证明该废水中是否含有CO32-的实验方案为。
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g)ΔH1=-574 kJ·mol-1
CH4(g) + 4NO(g) =" 2" N2(g)+CO2(g) + 2H2O(g)ΔH2
若1 mol CH4 还原NO2 至N2,整个过程中放出的热量为867 kJ,则ΔH2=;
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为: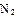 +3
+3
 2
2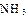 ,则在电化学合成氨的过程中,阴极反应式为_________;
,则在电化学合成氨的过程中,阴极反应式为_________;
(3)在一定条件下,将l mol N2 与3 mol H2 混合于一个10 L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,试回答:
①N2的转化率为;
②右图中在状态A时,平衡常数 KA(填写代入数值
的表达式,不要求算出具体数值);当温度由T1变化到T2时,
KA KB(填“>”、“<”或“=”)。
③在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
反应从0 min到3 min之间,H2的反应速率为;反应在3 min时,条件发生了改变,改变的条件可能是(填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度
现有A、B、C、D、E五种短周期元素,已知他们的原子序数依次增大,元素A的原子只有一个电子层;又知元素A能分别与元素B、C、D形成电子总数相等的化合物分
子X、Y、Z,Y有刺激性气味,Z常温下为液态,元素E的单质的水溶液有漂白性。
请回答下列问题:
(1)元素E的单质的饱和溶液与石灰石反应后所得溶液的漂白性增强的原因是 ;
(2) 在锅炉水中加入C2A4,可以把锅炉表面的氧化铁还原为结构紧密的四氧化三铁保护层,C2A4被氧化,且反应中无污染物生成,写出反应的化学方程式(不必配平),1 mol C2A4参加反应转移电子的数目为,氧化产物的化学式为;
(3)化合物Y与元素C的最高正价氧化物的水化物按物质的量比为2:1完全反应后的水溶液呈性(填“酸”“碱”或“中”),溶液中离子浓度由大到小的顺序为;
(4)用X、D2 和能传导O2-的的固体电解质组成的原电池中,负极的电极反应式为。
(5)A、B、D三种元素可以形成最简式为B2A4D且有香味的有机物,该有机物在酸性条件下可以水解,生成含碳原子数相同的两种常见有机物,这两种有机物均可用作食品调味剂。则这种有香味的有机物在一定条件下水解的化学方程式是。