下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用化学用语回答下列问题:
| 族 周期 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
|
|
|
⑥ |
|
⑦ |
|
|
| 3 |
① |
③ |
⑤ |
|
|
|
⑧ |
⑩ |
| 4 |
② |
④ |
|
|
|
|
⑨ |
|
(1)10种元素中,第一电离能最大的是______(填元素符号);电负性最小的金属是 (填元素符号)。
(2) ①、③、⑤的最高价最高价氧化物对应的水化物中,碱性最强的是______________________(填化学式)。
(3) ②、③、④三种元素可形成的离子,离子半径由大到小的顺序为____________________(填离子符号)。
(4) ①和⑨两元素形成化合物的化学式为 ,该化合物灼烧时的焰色为
色;该化合物的溶液与元素⑧的单质反应的离子方程式为
(5) 用电子式表示第三周期元素中电负性最小的元素和电负性最大的元素形成化合物的过程 。
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。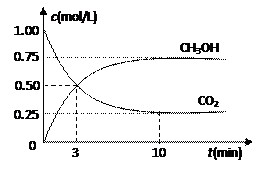
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)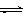 CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。
②该反应的平衡常数表达式为__________________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1mol CO2和3mol H2 |
⑵在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2 CO2=2 CO+O2,CO可用作燃料。
已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O
则阴极反应式为:________________________________。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由:______________________________________________。
下图所示各物质是由1~20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出。已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于饮水消毒。反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。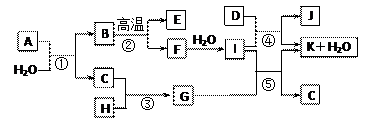
请回答下列问题:
⑴物质E的电子式是____________。
⑵反应⑤的化学方程式为___________________________________________。
⑶反应③的现象为___________________________________________。
⑷物质A由三种元素组成,1molA与水反应可生成1molB和2molC,A的化学式为________。
。
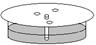
甲基橙和酚酞在水中和有机溶剂中的溶解度不同,当溶剂沿滤纸流经混合物点样时,甲基橙和酚酞会以不同的速率在滤纸上移动,从而达到分离的目的。某校化学兴趣小组拟通过该原理将甲基橙和酚酞从混合溶液A中分离开来:
步骤Ⅰ 把0.1 g甲基橙和0.1 g酚酞溶解在10mL60%的乙醇溶液里,配制混合溶液A;另将10mL乙醇和4mL浓氨水充分混合,配成混合溶液B;
步骤Ⅱ 在一张圆形滤纸中心扎一小孔,将细纸芯插入滤纸中央(如图)。在距滤纸中心约1cm的圆周上,选择三个点,分别用毛细管将A溶液在该三点处点样;
步骤Ⅲ 将滤纸覆盖在盛有B溶液的培养皿上,使滤纸芯与溶液接触,放置一段时间,点样逐渐向外扩散,形成黄环;
步骤Ⅳ 待黄环半径扩散到滤纸半径的二分之一时,取下滤纸,等滤纸稍干后,喷上饱和Na2CO3溶液,通过现象判断分离的效果。
试回答下列问题:
⑴本实验采用的分离方法叫_________,若分离淀粉胶体与氯化钠的混合液则可选用______法;
⑵步骤Ⅱ中若在滤纸上事先作点样位置标记,宜选用_____________笔(填“钢”或“铅”);
⑶步骤Ⅳ中喷洒Na2CO3溶液后,能观察到的现象是__________________________,这说明实验中________在滤纸上移动速率更快(填“甲基橙”或“酚酞”);
⑷他们可以通过_____________________________来判断分离的效果。
(1)为防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用。请写出燃烧时,有关“固硫”(不使含硫化合物进入大气)反应的化学方程式:_________________________________。
(2)近年来,某些自来水厂在用液氯进行消毒处理时还加入少量液氨,其反应的化学方程式:NH3+HClO H2O+NH2Cl(一氯氨),NH2Cl较HClO稳定,试分析加液氨能延长液氯杀菌时间的原因是。
H2O+NH2Cl(一氯氨),NH2Cl较HClO稳定,试分析加液氨能延长液氯杀菌时间的原因是。
将2 mol H2O和2 mol CO置于1 L容器中,在一定条件下,加热至高温,发生如下可逆反应:
2H2O(g) 2H2+O22CO+O2
2H2+O22CO+O2 2CO2
2CO2
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是___________和___________,或___________和___________。(填它们的分子式)
(2)若平衡时O2和CO2的物质的量分别为n(O2)平=a mol,n(CO2)平=b mol。试求n(H2O)平="______" 。(用含a、b的代数式表示)