实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。
某学生设计了如下方案:已知:NH4HCO3  NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑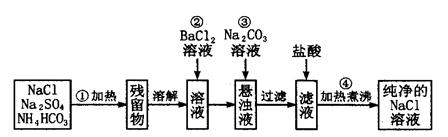
如果此方案正确,那么:
(1)操作②是否可改为加硝酸钡溶液?______ 理由是 。
(2)进行操作②后,如何判断SO42-已除尽,方法是___________________
(3)操作③的目的是________________________
(4)操作④的目的是_________________________________
如图是在一定温度下,向不同电解质溶液中加入新物质时溶液的导电性能发生变化,其电流强度(I)随新物质加入量(m)的变化曲线,以下四个导电性实验,其中与A图变化趋势一致的是______,与B图变化趋势一致的是______,与C图变化趋势一致的是______。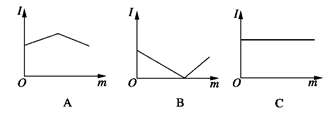
①氢氧化钡溶液中滴入硫酸溶液至过量;
②醋酸溶液中滴入氨水至过量;
③澄清石灰水中通入CO2至过量
④氯化铵溶液中逐渐加入适量氢氧化钠固体
下列物质中属于强电解质的是 。
①含有强极性键的HF ②不溶于水的BaSO4、AgCl ③稀H2SO4溶液 ④易溶于水的醋酸 ⑤Na2O、Na2O2、NaCl ⑥水溶液浓度为0.1 mol·L-1,pH=1的HA ⑦NH3的水溶液⑧氯水
书写电离方程式
硫酸氢钠(熔融) ;
亚硫酸 ;
一水合氨 。
已知一定温度和压强下,在容积为1 L的密闭容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g) + B(g) C(g) △H<0。2min达到平衡时,C的物质的量浓度为0.4mol/L。试回答有关问题:
C(g) △H<0。2min达到平衡时,C的物质的量浓度为0.4mol/L。试回答有关问题:
(1)C的反应速率为 。
(2)升温时,C的反应速率_______(填“加快”、“减慢”或“不变”)。
(3)A的转化率为 。
(4)若平衡时,保持容器压强不变,充入惰性气体,则平衡_______。
| A.一定向正反应方向移动 |
| B.一定向逆反应方向移动 |
| C.一定不移动 |
| D.不一定移动 |
(5)反应达到平衡时,C的体积分数为_______;
(6)平衡常数K的值为 (用分数表示)。
对于A+2B(气) nC(气)在一定条件下达到平衡后,改变下列条件,请回答:
nC(气)在一定条件下达到平衡后,改变下列条件,请回答:
(1)A量的增减,平衡不移动,则A为______态(填“气”或“非气”)。
(2)增压,平衡不移动,当n=2时,A的状态为________态;(填“气”或“非气”)
当n=3时,A的状态为______态。(填“气”或“非气”)
(3)若A为固体,增大压强,C的组分含量减少,则n____2(填>、=、<)
(4)升温,平衡向右移动,则该反应为________反应(填吸热或放热)。