为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)

实验过程:
Ⅰ.打开弹簧夹K1-K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,单后关闭K1、K2、K3 .
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中的溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
Ⅵ.更新试管D,重复过程Ⅵ,检验B溶液中的离子.
(1)过程Ⅰ的目的是___________________________
(2)棉花中浸润的溶液为_______________________
(3)A中发生反应的化学方程式为_____________________________________________
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是___________________
(5)过程Ⅳ中检验B溶液中是否含有硫酸根的操作是______________________________
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化Cl2>Fe3+>SO2的是
| |
过程Ⅳ B溶液中含有的离子 |
过程Ⅵ B溶液中含有的离子 |
| 甲 |
有Fe3+无Fe2+ |
有SO42- |
| 乙 |
既有Fe3+又有Fe2+ |
有SO42- |
| 丙 |
有Fe3+无Fe2+ |
有Fe2+ |
分类法对研究化学物质和化学反应有重要的意义,请完成下列问题。
今有七种物质:①铝线②熔化的KNO3③氯气④NaCl晶体⑤液态氯化氢⑥石灰水⑦乙醇
其中能导电的物质是,属于电解质的是,属于非电解质的是。
复分解反应的条件是生成_____________、_____________或____________。
化肥在农业生产中占有重要位置。国内外农学专家普遍认为,在其他生产因素不变的情况下,农作物施用化肥可增产40%-60%。合成氨工业可以提供大量的氮肥,是满足人类对粮食增长需求的非常重要的化学工业。
(1)在工业合成氨的反应中,由于该反应在常温常压下,慢得几乎不能觉察,要实现工业化非常困难,许多化学家为此进行了不懈的努力。他们先从温度和压强着手,温度升高对提高化学反应速率(填有利、不利或无关),增加压强对提高化学反应速率(填有利、不利或无关),科学家们虽然选择了合适的温度和压强,但效果不佳,仍无法投入工业化生产。德国化学家哈伯(Fritz Haber,1868-1934)通过努力,在使用合适催化剂的情况下终于解决了这个问题,实现了合成氨的工业化生产。你认为该反应能工业化生产的关键是
(2)合成氨是重要的人工固氮方法,除人工固氮外,还有自然固氮,闪电固氮就是自然固氮的一种方式,课堂上可用高压发生器模拟这一过程,装置如图所示: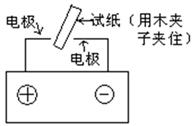
实验开始后,可以看到湿润的蓝色石蕊试纸变红色,请解释原因(用反应的化学方程式表示)
发生天然气井喷事故中喷发出的天然气含有硫化氢气体,请你用学到的知识回答下列问题:
(1)为防止井喷事故中更大的人员伤亡,抢救人员欲采用点火燃烧方法来除去有毒气体,试写出反应的化学方程式
(2)在石油钻井中,为防止井喷事故,要根据井下压强,将重晶石(密度4.5g/cm3左右)与泥浆按一定比例混合后灌入井中。写出重晶石的化学式试说明重晶石粉做压井材料的原因
(3)含硫地区钻井液的pH值应控制9.5以上,若用氢氧化钠溶液做控制液,写出发生反应的化学方程式
亚硝酸钠(NaNO2)是一种工业用盐,有像食盐一样的咸味,常被误食引起中毒。已知氢碘酸(HI)与NaNO2反应生成碘单质和一氧化氮气体。
(1)上述反应的离子方程式为。
(2)上述反应中,氧化剂是,发生氧化反应的物质是。
(3)根据上述反应,可以用试纸和生活中常见的物质进行实验,来鉴别亚硝酸钠和食盐。可选用的物质有:①自来水②碘化钾淀粉试纸③淀粉④白糖⑤食醋⑥白酒。进行实验时,必须选用的物质有(填写序号)。