某研究性学习小组对铝热反应实验展开研究。现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
| 熔点/℃ |
660 |
2054 |
1535 |
1462 |
| 沸点/℃ |
2467 |
2980 |
2750 |
- |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_________________(填“合理”或“不合理)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是______________,反应的离子方程式为_________________________________。
(3)实验室溶解该熔融物,下列试剂中最好的是____________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
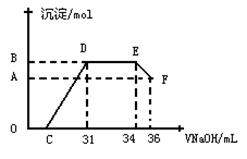
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入8mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。
试回答下列问题:
(1)写出图中各段 反应的离子方程式:O~C___________________E~F段______________;
(2)上述现象说明溶液中_________________结合OH-的能力比_______强(填离子符号)。
(3) B与A的差值为_________mol。B点对应的沉淀的物质的量为________mol,C点对应的氢氧化钠溶液的体积为___________mL
(4)为测定熔融物各成分的质量分数,有下列几种方案,其中正确的是______________。比较好的是_________。
A.熔融物的质量(m)和用NaOH处理该熔融物后溶液增加的质量(n);
B.熔融物用NaOH处理该熔融物后增加的质量(n)与产生的标准状况下气体的体积(V);
C.熔融物的质量(m)和用稀硫酸处理该熔融物后产生的标准状况下气体的体积(V);
按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物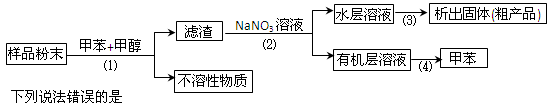
| A.步骤(1)需要过滤装置 | B.步骤(2)需要用到分液漏斗 |
| C.步骤(3)需要用到坩埚 | D.步骤(4)需要蒸馏装置 |
实验题:
I、下列方法适用于实验室中制备氨气的是____________________
A.固态氯化铵加热分解 B.向固体氢氧化钠中滴加浓氨水
C.氯化铵溶液与氢氧化钠溶液共热 D.固体氯化铵与氢氧化钙固体混合加热
II、为了在实验室中利用工业原料制备少量氨气,有人设计了如图所示的装置(图中夹持装置均已略去)。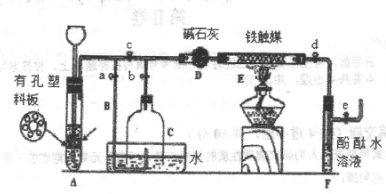
实验操作如下:
①检查装置的气密性后,关闭弹簧夹A.B.C.D.e。在A中加入锌粒,向长颈漏斗注入一定量的稀硫酸。打开弹簧夹C.D.e,则A中有氢气产生。在F出口处收集到氢气并检验其纯度。
②关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③用酒精灯加热反应管E,继续通入氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
请回答下列问题:
(1)写出反应管E中发生反应的化学方程式_______________________________________
用方程式解释F中溶液变红的原因______________________________________________
(2)C瓶内水位下降到液面保持不变时,A装置内发生的现象为____________________________,防止了实验装置中压强过大。此时再打开弹簧夹b的原因是___________________________,,C中气体的主要成分为.__________________________________________.
(3)为什么用酒精灯加热反应管E-段时间后再打开弹簧夹b____________________________
(4)为什么F装置不用防倒吸的装置_________________________________________________
(15分)某研究小组利用下图装置探究铜与浓硫酸反应的产物。
实验步骤与现象如下:
①检查装置气密性,向A中加入5 mL浓硫酸,打开K,将铜丝伸入浓硫酸中,给A处加热,观察到B中品红溶液褪色,再关闭K。
②实验观察到A中液面下铜丝变黑,产生气泡,液面上方产生大量白雾,一段时间后溶液中有白色固体出现,拉出铜丝,停止加热。回答下列问题:
(1)溶液中白色固体是_______ (填化学式),C中CCl4的作用是______________。
(2)取出铜丝,用蒸馏水洗净后伸入到稀硫酸中,铜丝变亮、溶液变蓝。写出A中可能发生反应的化学方程式:_____________________、_____________________。
(3)分离出C中的上层液体,滴加过量稀盐酸和BaCl2溶液,有白色沉淀产生。①分离的操作名称为:______________:②白色沉淀为:______________; ③产生白色沉淀的原因可能是___________________。
(16分) 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,通入水蒸气,并加热,就可以完成高温下“Fe与水蒸气的反应实验”。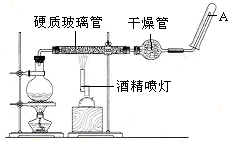
请回答该实验中的问题。
(1)写出该反应的反应方程式:。
(2)实验前必须对整套装置进行气密性检查,操作方法是。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是。
(4)酒精灯和酒精喷灯点燃的顺序是先点燃酒精灯,产生水蒸气后,再点燃酒精喷灯;原因是。
(5)干燥管中盛装是的物质是。
(6)试管中收集气体是H2 ,如果要在A处玻璃管处点燃该气体,则必须对该气体进行,
这一操作的目的是。
硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。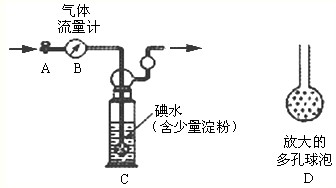
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是。
(2)洗气瓶C中的溶液可以用其他试剂替代,请你举出一种:。
(3)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量 (填“偏高”、“偏低” 或“无影响”)。
乙方案:实验步骤如下面流程图所示:
(4)写出步骤②中反应的化学方程式。
(5)步骤③中洗涤沉淀的方法是。
(6)通过的尾气体积为VL已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为
(用含有V、m的代数式表示)。
丙方案:将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液中,其余步骤与乙方案相同。
(7)你认为丙方案是否合理,说明理由:。