(化学---选修物质结构与性质)Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+ 的核外电子排布式是 。
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的 形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。
| A.稳定性:甲>乙,沸点:甲>乙 | B.稳定性:甲>乙,沸点:甲<乙 |
| C.稳定性:甲<乙,沸点:甲<乙 | D.稳定性:甲<乙,沸点:甲>乙 |
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为 .(用元素符号作答)
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 。
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 。
(16分)X、Y为常见的两种单质,Z是氧气,A、B为常见化合物。它们在一定条件下可发生如图所示的反应(均是在非溶液中进行的反应):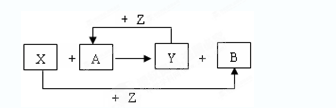
(1)画出Z的原子结构示意图;
(2)当X为金属,Y为非金属时,A可能的电子式为 或 ;
(3)当X为非金属,Y为金属时,X可能的化学式为 或 ;
(4)当X与Y均为金属时,写出X与A反应的化学方程式 ;
(5)当X与Y均为非金属时,若X与Y同主族,写出X与A反应的化学方程式 ;
若X与Y不在同一主族,写出X与A反应的化学方程式 。
(12分)透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质: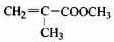
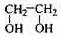
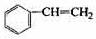

(甲) (乙) (丙) (丁)
填写下列空白:
(1)下列试剂能与甲反应而褪色的是___________(填标号)
a. Br2/CCl4溶液 b.石蕊溶液 c.酸性KMnO4溶液
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:_______
(3)淀粉通过下列转化可以得到乙(其中A—D均为有机物):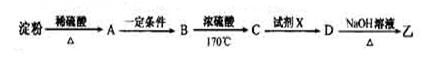
A的分子式是___________,试剂X可以是___________。
(4)已知:
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是。
下列物质:①水晶 ②干冰 ③氨气 ④白磷 ⑤氩⑥氯化钠
⑦铁 ⑧晶体硅⑨过氧化钠 ⑩H2O其中:
(1) 将①②④⑥⑧⑩按照熔沸点由高到低的顺序排列(填序号)
(2)含有极性键的非极性分子的电子式是
(3) 晶体⑥中1个阳离子周围有个阴离子;熔化时只破坏共价键的晶体是(填序号)
(4)1 mol金刚石、水晶和白磷中含有共价键的数目之比为
(5)铁有δ、γ、α三种同素异形体,下图是它们的晶体结构图,三种晶体中铁原子周围距离最近的铁原子个数之比为。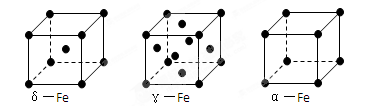
(1)在298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水放出热量,1558.3 kJ。写出该反应的热化学方程式。
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入乙烷和氧气。通入乙烷气体的电极应为极(填写“正”“负”)该电极上发生的电极反应式是
(3)右图所示实验装置中,石墨棒上的电极反应式为;如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 __________(填物质名称)。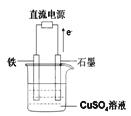
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。其中一种方法是还原沉淀法
该法的工艺流程为:CrO42- Cr2O72-
Cr2O72-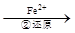 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若该平衡处在强酸性环境,则溶液显________色。
(2)能说明第①步反应达平衡状态的是。
A. Cr2O72-和CrO42-的浓度相同 B. 2v(Cr2O72-)=v(CrO42-) C.溶液的颜色不变
(3)第②步中,还原1 mol Cr2O72-离子,需要mol的FeSO4·7H2O。
写出第②步中反应的离子方程式____________________________________。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH―(aq)
Cr3+(aq)+3OH―(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH―)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至。