A、B、C、D四种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,A与D为同一主族,C元素的原子核外电子总数是电子层数的4倍,D是所在周期原子半径最大的元素。又知四种元素分别形成的常见单质在常温常压下有三种是气体,一种是固体。请回答下列问题:
(1)D在元素周期表中的位置是______ 。
(2) 由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为____ 。
(3) D与C形成的化合物可与Y反应生成单质Z,该反应的化学方程式为 ;若有1 mol电子转移,生成Z的物质的量为 mol。
(4) 写出实验室制备BA3的化学方程式______________________ 。将BA3 通入溴水中可发生反应,生成一种单质和一种盐,写出该反应的离子方程式 。
(5) 已知B2A4可燃烧生成B的单质和Y,以B2A4、O2、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池负极反应是_______________。以石墨为电极,用该电池电解100 mL饱和食盐水,一段时间后,在两极共收集到224 mL气体(标准状况下),此时溶液的pH是(忽略溶液体积的变化)________。
去冬以来,我国很多地方持续干旱,为此,农业专家建议尽快发展高能抗旱保水剂。保水剂是一种强吸水树脂,能在短时间内吸收自身重量几百倍至上千倍的水分。聚丙烯酸钠就是一种高吸水性树脂。下面是丙烯合成聚丙烯酸钠的化工流程:
请回答下列问题:
(1) 上述反应中属于加成反应的有____________,反应⑧的反应类型为____________;
(2)写出A的结构简式_______________,D中的官能团有____________;
(3) F是D的同系物,式量比D大14,写出2种符合下列要求的F的同分异构体(不考虑顺反异构)__________________ , ______________________;
①链状分子②与新制氢氧化铜在加热条件下反应生成红色沉淀
③与NaOH溶液混合后滴入酚酞,加热,溶液颜色变浅
(4)写出下列反应的化学方程式:
③_____________________________________________。
⑧_____________________________________________。
电镀广泛地应用于工业生产中。在电镀铬的工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+Fe3+和Al3+等,且酸性较强。为回收利用铬元索,此工业废水通常采用如下流程处理: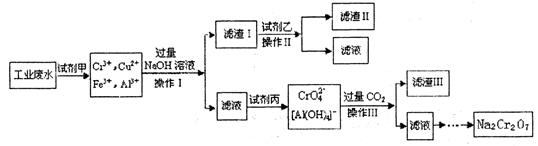
已知: (1)铬元素有以下循环过程: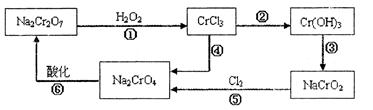
(2)Cu(OH)2能溶于氨水: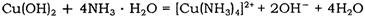
请回答下列问题:
(1)加入试剂甲的目的:________________
(2)试剂乙的名称:________ ,试剂丙的化学式:________________
(3)上述操作I、II、III相同,则进行该实验操作所需要的主要玻璃仪器有________________
(4)滤渣I的主要成分为________________(写化学式)。
(5)在铬元素循环过程的反应①中每反应掉1 mol H2O2同时消耗H+数目为:______________
(6)铬元素循环过程的反应⑥的离子方程式:_____________________________;
废水处理流程中生成滤渣III的离子方程式:_______________________
(1)I.图表法、图象法是常用的科学研究方法。
短周期某主族元素M的电离能情况如图(A)所示。则M元素位于周期表的第族。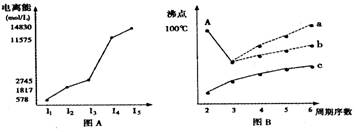
II.图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可表达第族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是:(填“a”或“b”),理由是:。
(2).人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”。试回答下列问题:
I.Ti元素的基态原子的价电子层排布式为 ;
II.在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定;
①偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如图,它的化学式是 ;晶体内与每个“Ti”紧邻的氧原子数为个。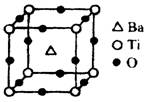
②已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液 ,均产生白色沉淀;
,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色 沉淀质量为紫色晶体的水溶液反应得到沉淀质量的。则绿色晶体配合物的化学式为 。
沉淀质量为紫色晶体的水溶液反应得到沉淀质量的。则绿色晶体配合物的化学式为 。
根据下面的反应路线及所给信息填空。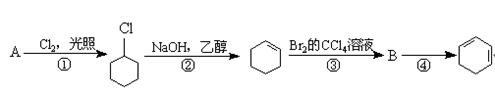
(1)A的结构简式是,名称是。
(2)①的反应类型是;②的反应类型是。
(3)反应④的化学方程式是 。
有机物A(C10H20O2)具有兰花香味,可用作香皂、洗发香波的芳香赋予剂。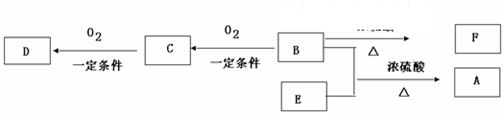
已知:
①B分子中没有支链。
②D能与碳酸氢钠溶液反应放出二氧化碳。
③D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被Cl原子取代,其一氯代物只有一种。
④F可以使溴的四氯化碳溶液褪色
(1)B可以发生的反应有(选填序号)。(多填扣分)
①取代反应 ②消去反应③加聚反应④氧化反应
②消去反应③加聚反应④氧化反应
(2)D、F分子所含的官能团的名称依次是、。(写名称)
(3)写出E结构简式:。
(4)E可用与生产氨苄青霉素等。已知E的制备方法不同于其常见的同系物,据报道,可由2—甲基—1—丙醇和甲酸在一定条件下制取E。
该反应的化学方程式是。