现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水)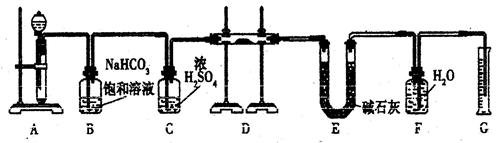
回答下列问题:
(1)装置A中液体试剂选用
(2)装置B的作用是 。
装置E中碱石灰的作用是 。
(3)装置D中发生反应的化学方程式是 ____________________ 。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为 。
为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。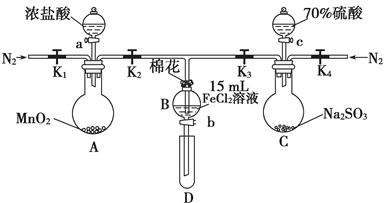
实验过程:
Ⅰ.打开弹簧夹K1~K4 ,通入一段时间N2 ,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a ,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,关闭K2 。
Ⅳ.打开活塞b,使约2 mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_____________________________________________________。
(2)检验B中溶液是否还有Fe2+ 的方法之一是:取少量B中溶液于试管中,滴加几滴含有+3价铁元素的配合物溶液,会产生蓝色沉淀,写出该反应的离子方程式。
(3)若向第III步B中的黄色溶液中通入H2S气体,会观察到有淡黄色沉淀生成,写出该反应的离子方程式。
(4)若将制取的SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的化学方程式为_________________________________________________。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是________(填“甲”、“乙”或“丙”)。
| 过程Ⅳ,B溶液中含有的离子 |
过程Ⅵ,B溶液中含有的离子 |
|
| 甲 |
有Fe3+无Fe2+ |
有SO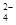 |
| 乙 |
既有Fe3+又有Fe2+ |
有SO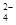 |
| 丙 |
有Fe3+无Fe2+ |
有Fe2+ |
(6)将B中的FeCl2溶液换成100mLFeBr2溶液并向其中通入1.12LCl2(标准状况下),若溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为。
第五主族的磷单质及其化合物在工业上有广泛应用。
(1)同磷灰石在高温下制备黄磷的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+ 30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)=CaSiO3(s)△H3
用△H1、△H2和△H3表示△H , 则 △H = ;
△H = ;
(2)白磷与氧气反应生成P4O10 固体。已知断裂下列化学键需要
吸收的能量分别为:
P—P a kJ·mol-1、 P—O b kJ·mol-1、
P==="O" c kJ·mol-1、 O==="O" d kJ·mol-1。
根据下图的分子结构和有关数据通过计算写出该反应的热化学方程式为。
(3)三聚磷酸可视为三个磷酸分子(磷酸结构式如右图)之间脱去两个水分子产物,其结构式为_____________________,三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为____________。
(4)次磷酸(H3PO2)为一元酸,分子中含一个羟基,其钠盐的正盐的化学式为,该盐可用于工业上的化学镀镍。
① 化学镀镍的溶液中含有Ni2+和H2PO2-, 在酸性等条件下发生下述反应:
(a)□Ni2+ +□H2PO2-+ □_____ = □Ni++ □H2PO3-+□____
(b)6H2PO-2 + 2H+ =" 2P" + 4H2PO3 - + 3H2↑
请在答题卡上写出并配平反应式(a);
② 利用①中反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
原理上的不同点:______________________________________________________;
化学镀的优点:________________________________________________________。
某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1 。 其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题。
(1)写出元素D在周期表中的位置是,B原子的外围电子排布图。填出:E原子的核外有种不同运动状态的电子,
B和C的第一电离能大小关系(用元素符号表示)。
(2)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,画出原子个数比为1:1的化合物的电子式,两种化合物可任意比互溶,解释其主要原因为。
(3)该配位化合物的化学式为。
(4)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为。用电子式表示化合物Na2D2的形成过程。
(5)已知E的晶胞结构如下图所示,此晶胞立方体的边长为a cm,E单质的密度为ρg·cm-3,则阿伏加德罗常数为(用a、ρ表示)。该晶胞配位数为,EDC4常作电镀液,其中DC 的空间构型是,其中D原子的杂化轨道类型是,若电解EDC4的水溶液,则电解总反应的化学方程式为。
的空间构型是,其中D原子的杂化轨道类型是,若电解EDC4的水溶液,则电解总反应的化学方程式为。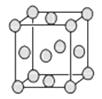
(12分)在Na+浓度为0.5 mol·L-1的某澄清溶液中,还可能含有下表中的若干种离子。
| 阳离子 |
K+Ag+Mg2+Ba2+ |
| 阴离子 |
NO CO CO SiO SiO SO SO |
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
| 序号 |
实验内容 |
实验结果 |
| Ⅰ |
向该溶液中加入足量稀盐酸 |
产生白色沉淀并放出标准状况下0.56 L气体 |
| Ⅱ |
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 |
固体质量为2.4 g |
| Ⅲ |
向Ⅱ的滤液中滴加BaCl2溶液 |
无明显现象 |
请回答下列问题。
(1)实验Ⅰ能确定一定不存在的离子是________________________。
(2)实验Ⅰ中与足量盐酸反应产生气体的阴离子,与少量盐酸也能反应,写出与少量盐酸反应的离子方程式为_______________________________。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)。
| 阴离子 |
NO |
CO |
SiO |
SO |
| c/mol·L-1 |
(4)判断K+是否存在,若存在求其最小浓度,若不存在说明理由:_____________________。
(共10分)向200 mL ,某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7。
(1)此时溶液的溶质如果是单一成分,可能是____________________;如果是多种成分,可能是__________________________。
(2)在上述所得溶液中,逐滴缓慢滴加2 mol·L-1的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示:
①加入盐酸200 mL之前,无气体产生,写出OA段发生反应的离子方程式___________________________________________________________________。
②B点时,反应所得溶液中溶质的物质的量浓度是__________(溶液体积的变化忽略不计)。