(12分)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H =-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g) △H =-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。

①能说明该反应已达平衡状态的是________
A.CO2的体积分数在混合气体中保持不变
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.反应中H2O与CH3OH的物质的量浓度之比为1:1, 且保持不变
②下列措施中能使 增大的是________ (选填编号)。
增大的是________ (选填编号)。
A.升高温度
B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离
D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K=___________ , 若改变条件 (填选项),可使K=1。
A增大压强 B增大反应物浓度 C.降低温度
D.升高温度 E.加入催化剂
|
(2)某甲醇燃料电池原理如图1所示:M区发生反应的电极反应式为_______________________________。

未来新能源的特点是资源丰富,在使用时对环境无污染或很少污染,且有些可以再生。下列属最有希望的新能源的是()
①天然气 ②煤 ③核能 ④水电 ⑤太阳能 ⑥燃料电池 ⑦风能 ⑧氢能
| A.①②③④ | B.⑤⑥⑦⑧ |
| C.③④⑤⑥ | D.除①②外 |
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气的生成速率加快的是()
| A.加入KHSO4固体 | B.不用铁片,改用铁粉 |
| C.滴加少量硫酸铜溶液 | D.加入KNO3固体 |
已知H—H键能为436 kJ·mol-1,H—N键能为391 kJ·mol-1,根据化学方程式:N2 + 3H2 = 2NH3ΔH = -92.4 kJ·mol-1,则N≡N键的键能是()
| A.431 kJ·mol-1 | B.946 kJ·mol-1 |
| C.649 kJ·mol-1 | D.869 kJ·mol-1 |
对有气体参加的某化学反应来说,在下图中可能作为横坐标的是() 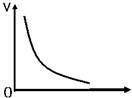
| A.温度 | B.压强 |
| C.反应物浓度 | D.反应时间 |
下列说法不正确的是()
| A.化学反应除了生成新物质外,还伴随着能量的变化 |
| B.吸热反应在一定条件(如常温、加热等)也能发生 |
| C.放热反应都不需要加热就能发生 |
| D.化学反应是放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量 |