已知25℃、101 kPa下,稀的强酸与强碱溶液反应的中和热为57.3 kJ/mol。
(1)写出表示稀硫酸与稀烧碱溶液发生反应的中和热的热化学方程式: 。
(2)学生甲用稀硫酸与稀烧碱溶液测定中和热装置如图。
①实验时所需的玻璃仪器除烧杯、量筒外还需: 。
②该装置中有一处错误是: ,如果用该错误装置测定,结果会 (填“偏
高”“偏低”“无影响”)
③如果,该生用50 mL 0.25 mol/L的稀硫酸与50 mL 0.55 mol/L的稀烧碱溶液,他用试剂的用量的理
由是: 。在该实验中需要测定某种数据,
完成一次实验,需要测定该数据的次数为 次。
(3)学生乙用2 mol/L的硫酸来测定与锌粒和锌粉反应的快慢,设计如图(Ⅰ)装置:

图Ⅰ 图Ⅱ
①该生两次实验测定时间均设定为10 min,那么他还要测定的另一个数据是:
。
②如果将图Ⅰ装置中的气体收集装置改为图Ⅱ,实验完毕待冷却后,该生准备读取滴定管上液面所处的刻度数,发现滴定管中液面高于干燥管中液面,应先采取的操作是: 。③该实验结果中,你估计与酸反应较快的是 。
铁、铝、铜等金属及其化合物在日常生活应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。 X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是;X与过量浓硝酸反应后溶液中含有的盐的化学式,检验该盐溶液中含有的阳离子的试剂为________________
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入过量的稀盐酸,所得溶液与原溶液相比,溶液中大量减少的阳离子是________
A.Mg2+ B.Fe2+C.Al3+D.Cu2+
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:
回答下列问题:
①操作Ⅰ的名称是,操作Ⅱ的名称是;
操作操作Ⅱ的方法为_____________________________________________________________
_______________________________________________________________________________
②Na2CO3溶液可以除油污,原因是(用离子方程式表示);
③请完成生成FeCO3沉淀的离子方程式:Fe2+ + HCO3- FeCO3↓+ + H2O
(4)有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+===
5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除
天平、玻璃棒、烧杯、胶头滴管外,还需。
②该实验中的KMnO4溶液需要酸化,用于酸化的酸是。
a.稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
③某同学设计的下列滴定方式,最合理的是(夹持部分略去)(填字母序号)
(Ⅰ)下列实验操作或实验叙述正确的是()
| A.可用过滤的方法除去氢氧化铁胶体中少量的氯化铁 |
| B.用酸式滴定管量取18.80mL的碳酸钠溶液 |
| C.配制0.1mol/L的硫酸时,用量筒量取浓硫酸,要洗涤量筒,否则配制的溶液浓度偏低 |
| D.振荡用饱和的碳酸钠溶液吸收乙酸乙酯的试管,发现有气泡冒出,它是CO2气体 |
E.实验室制取氨气时,常用无水氯化钙进行干燥
F.加入BaCl2溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,一定有SO42-
(Ⅱ)某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为沉淀可能是CuCO3;
乙同学认为沉淀可能是Cu(OH)2;
丙同学认为沉淀可能是CuCO3,和Cu(OH)2的混合物。
[查阅资料知:CuCO3和Cu(OH)2均不带结晶水]
(1)按照甲同学的观点,发生反应的离子方程式为______________________ ;在探究沉淀成分前,须将沉淀从溶液中分离并净化。其具体操作依次为______________________。
(2)洗涤所得沉淀的实验操作方法:_____________________________________________
(Ⅲ)若CuCO3和Cu(OH)2两者都有,可利用下列装置通过实验测定其组成。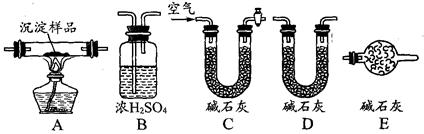
(1)实验装置的连接顺序为_________________________________
(2)装置C中碱石灰的作用是__________,实验开始和结束时都要通过量的空气,请说明结束时通入过量空气的作用是__________________________________ 。
(3)若沉淀样品的质量为mg,装置B质量增加了ng,则沉淀中CuCO3的质量分数为 ______________
(Ⅰ)下列实验操作或实验叙述正确的是()
A.可用过滤的方法除去氢氧化铁胶体中少量的氯化铁
B.用酸式滴定管量取18.80mL的碳酸钠溶液
C.配制0.1mol/L的硫酸时,用量筒量取浓硫酸,要洗涤量筒,否则配制的溶液浓度偏低
D.振荡用饱和的碳酸钠溶液吸收乙酸乙酯的试管,发现有气泡冒出,它是CO2气体
E.实验室制取氨气时,常用无水氯化钙进行干燥
(Ⅱ)红矾钠(重铬酸钠:Na2Cr2O2·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中用作氧化剂,应用十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)作原料利用以下过程来制取。
①步骤I中反应的化学方程式为:
4FeO·Cr2O3(s)+8Na2CO3(s)+7O2 8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。
8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。
A、升高温度 B、将原料粉碎 C、增加纯碱的用量 D、通入过量的空气
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外,还含有铝、硅元素的化合物,它们的化学式可能是__________。
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是_________________________________。
④步骤Ⅳ中发生反应的离子方程式为______________________________________________。
(2)将红矾钠与KCl固体按1:2(物质的量之比)混合溶于水后经适当操作可得到K2Cr2O7晶体。请填写表中空格,完成上述过程
| 序号 |
实验步骤 |
简述实验操作(不必叙述如何组装实验装置) |
| ① |
溶解 |
将混合物放入烧杯中、加水、充分搅拌直到固体不能溶解 |
| ② |
||
| ③ |
||
| ④ |
||
| ⑤ |
过滤、干燥 |
得到K2Cr2O7晶体 |
运用化学反应原理研究碳的氧化物的性质具有重要意义。
(1)CO2是一种重要的物质,但其过量排放,可能导致全球气温升高。下列措施不能够有效控制CO2所导致的温室效应的是_________(填序号)
①大力发展低碳产业,提倡低碳生活,依法控制CO2的过量排放
②禁止滥砍滥伐,植树造林,恢复生态
③开发利用各种新型能源代替煤、石油、天然气等化石能源
④提倡使用脱硫煤、无铅汽油等清洁燃料
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka =4.7×10-8。写出84消毒液露置在空气中发生反应的离子方程式___________________________。
(3)CO具有还原性,某同学设计图示装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应。
已知: ,则实验选择的最简单的装置接口连接顺序为________;
,则实验选择的最简单的装置接口连接顺序为________;
若CO能够与Na2O2发生反应,则预测反应产物为____________。实验后用球形干燥管中的固体进行验证可选择的试剂是_______________________________。
(4)已知C(s)+O2(g)=CO2(g),△H="-393.5" kJ·mol -1 ;CO(g)+ O2(g)=CO2(g),△H="-283.0" kJ·mol -1,写出CO2和C(s)反应的热化学方程式___________________。以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为______________________。若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)________L。
O2(g)=CO2(g),△H="-283.0" kJ·mol -1,写出CO2和C(s)反应的热化学方程式___________________。以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为______________________。若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)________L。
(1 6分)某化学兴趣小组用铝土矿(主要成分为A12 03,还含有Si02及铁的氧化物)提取氧化铝做冶炼铝的原料,提取的操作过程如下:
(1)实验室中制取CO2时,为了使反应随开随用、随关随停,应选用下图中的装置
(填字母代号)。
(2)在过滤操作中,除烧杯、玻璃棒外,还需用到的玻璃仪器有;
洗涤沉淀的操作是
(3)实验室制备氢氧化铝的方案有多种。现提供铝屑、氢氧化钠溶液、稀硫酸三种药品,若制备等量的氢氧化铝,请你从药品用量最少的角度出发,设计出最佳实验方案(方案不必给出),写出此方案中发生反应的离子方程式:
此方案中所用药品的物质的量之比是: =。
=。
(4)兴趣小组欲对铝土矿中铁元素的价态进行探究:取少量固体,加入过量稀硝酸,
加热溶解;取少许溶液滴加KSCN溶液后出现红色。由此得出,铁元素的价态为+3的结论。请指出该结论是否合理并说明理由。