氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用到氯气。工业上通常采用电解法制氯气:观察下图,回答: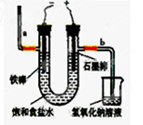
Ⅰ(1)若饱和食盐水中含有酚酞,通电后_____(填a或b)侧先变红。
(2)电解反应的化学方程式为__________________
Ⅱ某学生设计如下图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题: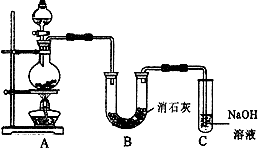
(1) 在A装置中用固体二氧化锰与浓盐酸在加热条件下制取氯气,反应化学方程式为  ,若在标准状态下收集到22.4升的氯气,则被氧化的HCl的物质的量是 。
,若在标准状态下收集到22.4升的氯气,则被氧化的HCl的物质的量是 。
(2) 漂白粉将在U形管中产生,其化学方程式是 。
(3) C装置的作用是 。
(4) 此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3) 2,为避免此副反应的发生,可采取的措施是 。
2,为避免此副反应的发生,可采取的措施是 。
②试判断另一个副反应(用化学方程式表示) 。为避免此副反应的发生,可将装置作何改进 。
(5)家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是 。
| A.食盐 | B.食醋 | C.烧碱 | D.纯碱 |
S2Cl2常用于橡胶硫化、有机物氯化的试剂,实验室可利用如下装置来制备S2Cl2。(部分夹持仪器已略去)
已知:①制备的反应方程式为:
②反应涉及的几种物质性质如下:
| 性质 物质 |
熔点 |
沸点 |
着火点 |
其他性质 |
| 单斜硫 |
119.2℃ |
446.6℃ |
363℃ |
/ |
| 斜方硫 |
112.8℃ |
446.6℃ |
363℃ |
/ |
| S2Cl2 |
-77℃ |
137℃ |
/ |
遇水强烈分解生成S、SO2和HCl |
回答下列问题:
(1)A部分仪器装配时,放好铁架台之后,应先固定(填仪器名称)。整套装置装配完毕后,应先进行,再添加试剂,冷凝水进水口是(填“a”或“b”)。实验完毕,A中不再产生氯气时,可拆除装置,拆除时,最先进行的操作应是。
(2)S2Cl2分子中各原子均达到8电子稳定结构,写出其电子式;用化学方程式表示撤去C装置的后果;用直接加热代替水浴加热的后果是。
(3)单斜硫、斜方硫互称为,从熔点、沸点、着火点等信息得到的启示是。
(4)M溶液可以选择下列试剂中的(填序号)
①碳酸钠溶液 ②氯化铁溶液 ③亚硫酸钠溶液 ④高锰酸钾溶液
乙醚极易挥发、微溶于水、是良好的有机溶剂。乙醇与浓硫酸的混合物在不同温度下反应能生成乙烯或乙醚。某实验小组用下图装置制取乙醚和乙烯。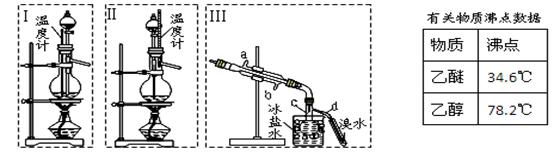
1.制乙醚:在蒸馏烧瓶中先加入10 mL乙醇,慢慢加入10 mL浓硫酸,冷却,固定装置。加热到140℃时,打开分液漏斗活塞,继续滴加10 mL乙醇,并保持140℃,此时烧瓶c中收集到无色液体。
(1)Ⅰ和Ⅱ是反应发生装置,应该选择(选答“Ⅰ”或“Ⅱ”)与装置Ⅲ相连。
(2)乙醇通过分液漏斗下端连接的长导管插入到液面下加入,目的有二,一是使反应物充分混合,二是
。
2.Ⅲ中水冷凝管的进水口是(选答“a”或“b”)。冰盐水的作用是。
3.有同学认为以上装置还不够完善,一是溴水可能倒吸,二是尾气弥漫在空气中遇明火危险。该同学设
计了以下几种装置与导管d连接,你认为合理的是(选填编号)。
4.反应一段时间后,升温到170℃,观察到反应物变为黑色,溴水褪色。写出实验过程中有气体生成化学方程式(写两个方程式);。
5.实验中收集到的乙醚产品中可能含有多种杂质。某同学设计了以下提纯方案: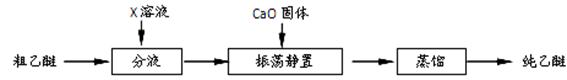
(1)分液步骤除去产品中的酸性杂质,则X可以是。
(2)蒸馏操作可除去的杂质是。
过碳酸钠(Na2CO3·3H2O2),有固体双氧水的俗称,该晶体具有Na2CO3和H2O2的双重性质,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,过碳酸钠的某生产流程如下图所示。
已知:2Na2CO3+3H2O2=2Na2CO3·3H2O△H<0;回答下列问题: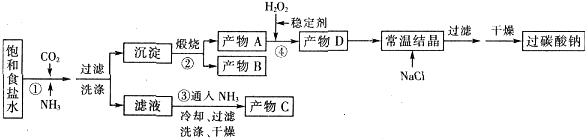
(1)下列物质可使过碳酸钠较快失效的是(填序号)_________。
| A.FeCl3溶液 | B.H2S | C.稀硫酸 | D.NaHCO3溶液 |
(2)反应①应先通入的气体是__________。
(3)在上述流程中,向反应前的H2O2中加入稳定剂的作用是____________________。
(4)该生产流程中可循环使用的物质是______________________________(填化学式)。
(5)生产过碳酸钠的流程中遗漏了一步,造成所得产品纯度偏低,请简述该步操作过程___________。
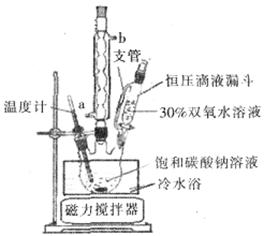
(6)实验室利用下图装置制备过碳酸钠,该装置中恒压滴液漏斗中支管的作用是_______,冷凝管应从__________处进水。
(7)由实验测定反应温度对产物的影响如下表:根据下表数据,你认为反应最佳的温度选择的范围是_______________。
| T/℃ |
活性氧百分含量 |
产率 |
| 5~10 |
13.94 |
85.49 |
| 10~15 |
14.02 |
85.78 |
| 15~20 |
15.05 |
88.38 |
| 20~25 |
14.46 |
83.01 |
 、
、
乙酰苯胺为无色晶体,具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称。在实验室制备乙酰苯胺常用苯胺与乙酸反应,反应方程式为: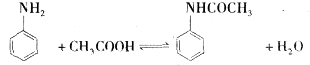
实验的具体操作步骤流程图:
相关的文献数据如下:
| 试剂名称 |
相对分子质量 |
密度g/ml |
熔点℃ |
沸点℃ |
溶解度 |
| 苯胺 |
93 |
1.02 |
-6.2 |
184.4 |
稍溶于水,与乙醇、乙醚、苯混溶 |
| 乙酸 |
60 |
1.05 |
16.7 |
118 |
溶于水、乙醇、乙醚等 |
| 乙酰苯胺 |
135 |
1.21 |
114~116 |
280~290 |
据此回答下列问题:
(1)实验时将苯胺、乙酸和锌粉放在单口圆底烧瓶中进行混合加热,所选单口圆底烧瓶的最佳规格是
A. 50mL B. 100mL C. 150mL D. 200mL
(2)量筒所接的蒸馏物是__________(填化学式)。实验这样设计的目的是__________。
(3)通过重结晶提纯产物,则乙酰苯胺在水中溶解性的变化特征是_________________。
(4)对无色片状晶体进行干燥,判断晶体干燥完全的实验方法是___________________。
(5)锌粉几乎不与纯净的乙酸反应,但随着上述制备乙酰苯胺的反应而会消耗乙酸,原因是_____。
(6)实验所得无色片状晶体干燥后称量目标产物质量为4.0g,请计算所得到乙酰苯胺的产率是___。
2013年6月,我国“蛟龙”号再次刷新“中国深度”——下潜7062米,为我国深海矿物资源的开发奠定了基础。海洋深处有丰富的锰结核矿,锰结核的主要成分是MnO2,同时还含有黄铜矿。
Ⅰ、“蛟龙”号外壳是用特殊的钛合金材料制成,它可以在7000m的深海中承受重压,Ti是以钛白粉(TiO2)为原料进行生产,钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的。TiO2+发生水解的离子方程式为____________________________。
Ⅱ、MnO2是一种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如下图所示:
(1)步骤Ⅱ中以NaClO3为氧化剂,当生成0.05molMnO2时,消耗0.1mol/L的NaClO3溶液200ml,该反应离子方程式为_______________________________。
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是____________。
Ⅲ、利用黄铜矿炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)可制备Fe2O3,方法为:
(A)用过量的稀盐酸浸取炉渣、过滤;(B)向滤液中加入5%的H2O2,再向其中加入过量的NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得到Fe2O3。根据以上信息回答下列问题:
(1)(B)中向滤液中加入5%的H2O2,其目的是_________________________________。
(2)设计实验证明炉渣中含有FeO___________________________________________。
(3)将煅烧得到的Fe2O3还原为Fe单质,再将质量为m g的Fe单质分成相等的四份,分别与50mL、100mL、150mL、200mL的等浓度的稀硝酸反应,反应产物NO在标况下的体积见附表:
| 实验 |
① |
② |
③ |
④ |
| V(HNO3)/ml |
50 |
100 |
150 |
200 |
| V(NO)/L |
1.344 |
2.688 |
3.36 |
3.36 |
则:①m=________g。
②写出实验②发生反应的化学方程式:_____________________________。