下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
| A |
SO2有漂白性 |
SO2能使溴水褪色 |
| B |
铁比铜活泼 |
铜容器可以盛放浓硝酸 |
| C |
铜绿的主成分是碱式碳酸铜 |
可用稀盐酸除去铜器表面的铜绿 |
| D |
铜表面易形成致密的氧化膜 |
铜板上的铁钉在潮湿空气中不易生锈 |
某气态的烷烃与烯烃的混合气体9 g,其密度为同状况下H2密度的11.2倍,将混合气体通过足量的溴水,溴水增重4.2 g,则原混合气体的组成为( )
| A.甲烷,乙烯 | B.甲烷,丙烯 | C.乙烷,乙烯 | D.甲烷,丁烯 |
CH4中混有CH2=CH2, 欲除去CH2=CH2得到CH4, 最好依次通过哪一组试剂( )
| A.澄清石灰水、浓硫酸 | B.KMnO4酸性溶液、浓硫酸 |
| C.溴水、浓硫酸 | D.浓硫酸、KMnO4酸性溶液 |
下列各组中的性质比较,正确的是()
①酸性:HClO4>HBrO4>HIO4②碱性:KOH>Ca(OH)2>Mg(OH)2
③稳定性:HCl>H2S>PH3④还原性:F-->Cl-->Br--
| A.①②④ | B.②③④ | C.①②③ | D.都正确 |
下列表达方式中错误的是( )
A.次氯酸电子式: 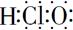 |
B.S2-的结构示意图: |
C.O—18的原子符号: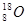 |
D.CO2分子的结构式:O=C=O |
2012年广西龙江发生重大镉污染事件,为了及时处理污染带来的危害,往江水里投放烧碱或石灰,使水呈碱性,生成氢氧化镉从而减轻污染。镉(Cd)是一种重金属元素,有多种核素。下列关于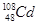 和
和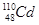 的说法正确的是( )
的说法正确的是( )
A.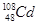 和 和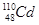 都含有48个中子 都含有48个中子 |
B.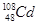 和 和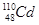 互为同位素 互为同位素 |
C.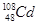 和 和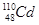 的核外电子数不同 的核外电子数不同 |
D.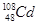 和 和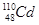 分别含有60和62个质子 分别含有60和62个质子 |