根据下列变化关系:
请填空:
(1)A物质的名称________,B溶液为_________,作用为________________________。
(2)写出④、⑥两步反应的化学方程式,在( )中标明反应类型。
④_______________________________________________________( );
⑥_______________________________________________________( );
有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们做了如下实验:
(1)将固体混合物溶于水,搅拌后得无色透明溶液
(2)往此溶液中滴加硝酸钡溶液,有白色沉淀生成
(3)过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解,试判断:
固体混合物中肯定有 ,肯定没有 ,可能有 ,对可能有的物质,可采用滤液中滴加 溶液方法来检验。
下列物质中,能导电的是 ,属于电解质的是 ,属于非电解质的是 。(填序号)①Cu、②液氨、③氯化钠晶体、④硫酸溶液、⑤干冰、⑥BaSO4、⑦金刚石
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品,工业上常用铝土矿(主要成分为Al2O3和少量的SiO2、Fe2O3杂质)生产铵明矾晶体NH4Al(SO4)2•12H2O,其工艺流程图如下: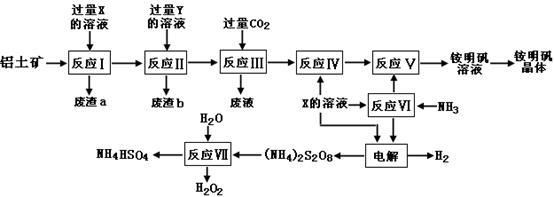
(1)废渣a、b 的成分分别是:_________、_____________。(写名称)
(2)流程图中X的化学式为:_______________。
(3)反应Ⅲ的离子方程式为:_________________________________________;从铵明矾溶液中获得铵明矾晶体的操作依次为(填操作名称)_________、冷却结晶、过滤洗涤。
(4)过硫酸铵[(NH4)2S2O8]在工业生产中有广泛的用途,可以作为氧化剂和漂白剂,广泛地用于蓄电池工业;还用作聚合的引发剂、纤维工业的脱浆剂。在上述的工艺流程中用惰性电极电解X与反应Ⅵ所得物质的混合溶液可以得到过硫酸铵。
写出阳极反应式:________________________ ____。
(5)反应Ⅶ的化学方程式为:_________________________ _____________;
NH4HSO4溶液中离子浓度由大到小顺序为:__________________________ _。
(6)向硫酸铝铵溶液中逐滴加入氢氧化钡溶液,不可能发生的反应是 (填选项字母)
| A.4NH4Al(SO4)2+3Ba(OH)2=2(NH4)2SO4+3BaSO4↓+ Al2 (SO4)3+2Al(OH)3↓ |
| B.2NH4Al(SO4)2+4Ba(OH)2=(NH4)2SO4+3BaSO4↓+Ba(AlO2)2 |
| C.2NH4Al(SO4)2+3Ba(OH)2=(NH4)2SO4+3BaSO4↓+2Al(OH)3↓ |
| D.NH4Al(SO4)2+2Ba(OH)2=NH3·H2O+2BaSO4↓+ Al(OH)3↓ |
(1)在一定温度下,向1L体积固定的密闭容器中加入1molA(g),发生反应2A(g) B(g)+C(g),B的物质的量随时间的变化如图所示。0—2min内的平均反应速率v(A)= . 相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时 是原来的2倍。
B(g)+C(g),B的物质的量随时间的变化如图所示。0—2min内的平均反应速率v(A)= . 相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时 是原来的2倍。
a.平衡常数 b.A的平衡浓度 c.达到平衡的时间
d.平衡时B的体积分数 e.平衡时混合气体的密度
f .平衡时混合气体的平均摩尔质量
(2)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若加入少量下列试剂中的 ,产生H2的速率
将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3 e. CH3COOH f.FeSO4
(3)用惰性电极电解Cu(NO3)2溶液一段时间后,加入a mol 的Cu(OH)2可使溶液恢复原状,则电解过程中转移的电子数目为_____________
(4)氯化铁溶液常作印刷电路铜板的腐蚀剂,得到含有Cu2+等的废液,有人提出可以利用如右图的装置从得到的废液中提炼金属铜。该过程中甲池负极的电极反应式是 ,若乙池中装入废液500mL,当阴极增重3.2g时,停止通电,此时阳极产生气体的体积(标准状况)为 (假设气体全部逸出)。
常温下,将0.01molNH4Cl和0.002molNaOH溶于水配成1L溶液,
(1)该溶液中存在的三个平衡体系是________________ 、
______________ ______、_____________________________。
(分别用化学用语表示,下同)
(2)溶液中共有 种不同的粒子。
(3)这些粒子中浓度为0.01mol/L的是 ,浓度为0.002mol/L的是 。
(4)物质的量之和为0.01mol的二种粒子是__________________________。
(5) 和 两种粒子数量之和比OH-多0.008mol