下图是用于气体的制备.干燥.性质实验、尾气处理的常用装置。请根据要求回答下列问题。
(1)怎样检查装置A的气密性 。
(2)某同学将仪器连接顺序为A-B-C-D,以此证明实验室制取Cl2的过程中有HCl和水蒸气挥发出来。
①A中的反应化学方程式是 。
②B中盛放的试剂是 ,C中盛放的是CCl4溶液,其作用是 ,D中盛放的试剂是 ,实验时看到的现象是 。
③有同学认为实验有缺陷,应该在C、D之间增加E装置,你认为该装置中.应放入 。
(3)最后,同学们用上述除B以外的仪器组装一套可以制出纯净干燥氯气的装置,按气流方向填出接口顺序a→ →ghf(不能选用B装置,其它装置可以重复使用;需要几个接口填几个).并按顺序写出所填接口对应仪器盛放的试剂 。
常温下,甲、乙、丙三位同学用实验确定某酸HA是弱电解质的方案分别是:
甲:用pH试纸测定0.1 moI/L HA溶液的pH,即可证明HA是弱电解质。
乙:①分别取pH=l的HA溶液和稀盐酸各10.00 mL,再加水稀释为100 mL:
②各取相同体积的两种稀释液(适量),同时分别加入纯度和形状大小均相同的锌粒(足量),观察现象,即可证明HA是弱电解质。
丙:将适量的HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,分析表中数据可以说明HA是弱电解质。
| 编号 |
NaOH/mol·L-1 |
HA/mol·L-1 |
混合溶液的pH |
| ① |
0.1 |
0.1 |
pH=9 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.1 |
0.2 |
pH<7 |
(1)甲的方案中,说明HA是弱电解质的理由是测得溶液的pH_______1(填“>”、“<”或“=”)。甲进行实验时的具体操作方法是_______________。
(2)在乙的方案的第①步中,需要用到的定量仪器是___________。pH均为1的HA溶液和稀盐酸中,水的电离程度的大小关系是____________(填字母)。
a.HA溶液中水的电离程度大
b.稀盐酸中水的电离程度大
c.两种溶液中水的电离程度相同
(3)乙的方案中,说明HA是弱电解质的主要现象是_________(填字母)。
A.装稀盐酸的试管中放出H2的速率快
B.装HA溶液的试管中放出H2的速率快
C.两个试管中产生气体的速率一样快
(4)丙的方案中,编号②中的c_______(填“>”、“<”或“=”)0.l,该混合液中的离子浓度:c(Na+)________(填“>”、“<”或“=”)c(A-)。
(5)丙的方案中,编号③的数据表明,混合溶液中HA的电离程度比NaA的水解程度:________(填“强”、“弱”或“无法确定”)。
研究工业废弃物的处理和防治具有重要的意义。
(1)利用反应CH4+2NO2 N2+CO2+2H2O可消除NO2的污染,该反应中氧化剂是____,当消耗CH4的体积是11.2 L(标准状况下)时,理论上可处理____molNO2。
N2+CO2+2H2O可消除NO2的污染,该反应中氧化剂是____,当消耗CH4的体积是11.2 L(标准状况下)时,理论上可处理____molNO2。
(2)治理汽车尾气中CO和NO的一种方法是:在汽车排气管中安装一个催化转化装置,该装置能将CO和NO转化为参与大气循环的无毒气体。该反应的化学方程式为______________.
(3)某无色废水中可能含有Fe3+、Al3+、Na+、Cl-、OH-、SO42-、中的几种离子。分别取三份废水进行如下实验:
I.进行焰色反应实验,火焰为无色。
Ⅱ.取100 mL废水,加入足量的BaCl2溶液,生成2.33g白色沉淀。
Ⅲ.取100 mL废水,逐滴加入1.0 mol/L的NaOH溶液,消耗NaOH溶液的体积与生成沉淀的质量如下图所示。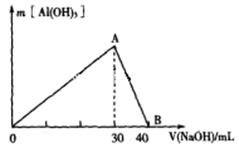
请根据上述信息回答下列问题:、
①该废水中一定不含有的离子是__________.
②实验中需配制1.0 mol/L的NaOH溶液100 mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器有_______。
③写出图中A→B反应的离子方程式:_________________。
④通过计算,该废水中______Cl-(填“含有”或“不含有”);若含有,则c(Cl-)=________(若不含有,此问不必作答)。
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:氧化性: >Fe3+>I2;还原性:S2O32—>I-。3I2+6OH-=IO3—+5I-+3H2O;KI+I2
>Fe3+>I2;还原性:S2O32—>I-。3I2+6OH-=IO3—+5I-+3H2O;KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质是________(填化学式);CCl4中显紫红色的物质是_________(用化学式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为____________、____________。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境下KI与氧气反应的化学方程式:________________。将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?______(填“是”或“否”),并说明理由__________________。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是__________________。
| A.Na2S2O3 | B.AlCl3 | C.Na2CO3 | D.NaNO2 |
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+____________________。
某实验小组利用如下装置合成化工原料正丁醛。发生的反应如下:

反应物和产物的相关数据列表如下:
| 沸点/℃ |
密度/(g·cm-3) |
水中溶解性 |
|
| 正丁醇 |
117.2 |
0.810 9 |
微溶 |
| 正丁醛 |
75.7 |
0.801 7 |
微溶 |
实验步骤如下:
将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在C中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,再将有机层干燥、蒸馏后得正丁醛2.0 g。
回答下列问题:
(1)实验中不能将Na2Cr2O7溶液加到浓硫酸中的理由是 。
(2)加入沸石的作用是 。
(3)分液漏斗使用前必须进行的操作是 。
(4)反应温度应保持在90~95℃,其原因是 。
(5)本实验中,正丁醛的产率为 。
以下是实验室常用的部分仪器。
请回答下列问题:
(1)序号为⑧和⑩的仪器分别为、(填名称、下同)。
(2)能作反应容器且可直接加热的是 。
(3)在分液操作中,必须用到仪器是 (填序号、下同)。
(4)在配制一定物质的量浓度的溶液时,需要上述仪器中的 。
(5)仪器上标有温度的是 。
(6)下图是温度计、量筒、滴定管的一部分,下述读数(虚线刻度)及说法正确的是________。
a.①是量筒,读数为2.5 mL b.②是量筒,读数为2.5 mL
c.③是滴定管,读数为2.5 mL d.②是温度计,读数是2.5 ℃
(7)某同学想用大理石和稀盐酸反应制取少量CO2。教师指出,若用下列装置制取会浪费大量的稀盐酸。于是该同学选用了上述①~⑩中的一种仪器,添加在下列装置中,解决了这个问题。请你将需要添加的仪器画在下图中的合适位置。