将含镁、钾的盐湖水蒸发,最后得到的产物中含光卤石(xKCl·yMgCl2·zH2O)。它在空气中极易潮解,易溶于水,是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定。
①准确称取5.550 g样品溶于水,配成100 mL溶液。
②将溶液分成二等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.580 g。
③在另一份溶液中加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体4.305 g。
(1)步骤②中检验白色固体已洗净的方法是 。
(2)已知某温度下Mg(OH)2的Ksp = 6.4×10-12,当溶液中c(Mg2+)≤1.0×10-5 mol·L-1可视为沉淀完全,则应保持溶液的OH-的浓度≥ mol·L-1。
(3)通过计算确定样品的组成(写出计算过程)。
(7分)铝是应用最广泛的金属之一,铝的化合物在生产和生活中也有许多用途。
(1)铝制容器不能盛装NaOH溶液,主要原因是什么?(用化学方程式表示)
(2)胃舒平是治疗胃酸(HCl)过多的常用药物,其中含有的有效成分是氢氧化铝,其治疗原理是(用离子方程式表示):
(3)为完全沉淀硫酸铝溶液中的铝元素常加入过量的
(3分)(1)我国政府规定食用盐中必须加入一定量的KIO3(碘酸钾),其中碘元素的化合价为 价。
(2)海水中镁的总储量约为2×1015 t,目前世界上生产的镁有60%来自海水,海水中的镁元素处于 (填“游离态”或“化合态”),从海水中提取氯化镁 (填 “属于”或“不属于”)氧化还原反应。
(7分)金属钠的化学性质很活泼,它在空气中很容易变质,可以与冷水发生剧烈反应。
(1)钠在上述空气、冷水中发生反应中 (填“得”或“失”)电子,表现出 _____________性(填“氧化”或“还原”)。
(2)少量的金属钠应该保存在 中。
(3)写出钠与水反应的化学方程式 。
(4)当有0.2mol电子发生转移时,生成氢气的体积为 (标准状况)
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为。
(2)B的氢化物的分子空间构型是。其中心原子采取杂化。
(3)写出化合物AC2的电子式;一种由B、C组成的化合物与AC2互为等电子体,其化学式为。
(4)E的核外电子排布式是,ECl3形成的配合物的化学式为。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是。
磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右图为磷化硼晶体结构中最小的重复结构单元。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr。回答下列问题: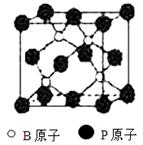
(1)写出基态磷原子的外围电子轨道表示式
(2)磷化硼的晶体类型是 ,B原子的杂化方式是 。
(3)电负性:N B (填“>”、“<”)
(4)BP中每个B或P原子均形成4个共价键,其中有一个配位键,提供空轨道是 原子。
(5)BBr3分子中,B原子采取sp2杂化,则BBr3属于 (填“极性”或“非极性”)分子。
(6)氮化硼晶体的熔点要比磷化硼晶体高,其原因是 。