(15分)利用下图所示实验(部分装置)收集氯气并验证氯气的性质: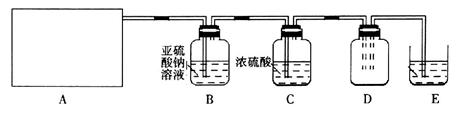
(1)A为Cl2的发生装置。若制取氯气的化学方程式为________________,与之对应的A装置是__________(填写装置的序号)。
(2)利用D中的广口瓶收集氯气,试在装置图中完善D装置(将虚线表示的一根或两根导管改为实线,也可都不改)。
(3)写出装置E中反应的离子方程式________________。
(4)利用D中收集的氯气进行铁与氯气的反应实验:用坩埚钳夹持一束细铁丝, ______________,然后伸入盛有氯气的集气瓶中。
(5)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-,反应的离子方程式为__________。试设计实验方案,检验洗气瓶B溶液中Cl 和SO
和SO 的存在。可供选择的试剂及仪器为:
的存在。可供选择的试剂及仪器为:
稀盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液、AgNO3溶液、澄清石灰水、试管、胶头滴管。
写出下列有机物的系统命名或结构简式:
(1)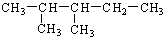 (2)
(2)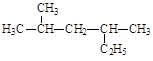
___________________________ _________________________
(3)2,2-二甲基-3-乙基己烷(4)2-甲基-2-丁烯
___________________________ _________________________
(16分)有一瓶澄清的溶液,其中可能含有NH4+、K+、Na+、Mg2+、Al3+、Fe3+、Ba2+、Cl-、I-、NO3-、CO32-、SO42-中的几种。取该溶液进行以下实验:
(1)用pH试纸检验该溶液呈强酸性,排除离子的不存在。
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4层呈紫红色,可以排除
离子不存在。
(3)另取部分溶液,向其中逐滴加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,均无沉淀产成,则可排除离子不存在。取部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝,说明离子存在
(4)另取部分上述碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成,可以排除离子不存在。
(5)根据以上实验事实确定:该溶液中肯定存在的离子是;还不能肯定是否存在的离子是,写出第(3)步操作的离子反应方程式为。
二甲醚(CH30CH3,沸点为-24.9℃)被称为21世纪的新型能源。科学家利用太阳能分解水生成的氢气与从烟道气中分离出的C02在催化剂作用下合成二甲醚,并开发出直接以二甲醚为燃料的燃料电池。其合成流程如下: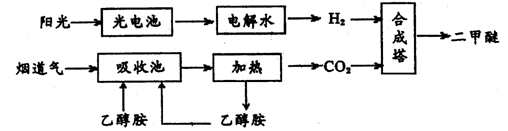
(1)已知:CH30CH3(g)、H2(g)的标准燃烧热分别为:△H= -1455.OkJ.mol-1、△H=" -285.8" kj.mol-1。写出以CO2、H2合成CH3OCH3的热化学方程式:。
(2)15~20%的乙醇胺.(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作C02吸收剂。写出吸收C02反应的化学方程式。
(3)一定条件下用C02和H2合成二甲醚,反应物气流量对C02的转化率、二甲醚的选择性(是指转化生成二甲醚的碳占已转化碳的比例)影响结果如图9所示,当控制气流量为28mL.min-1时,则生成0.3mol二甲醚需要通入C02的物质的量为。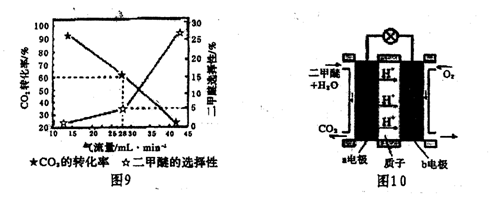
(4)图10为二甲醚燃料电池示意图。
①b电极为,a电极的电极反应式为。该燃料电池的最大障碍是氧化反应不完全而产生(填物质名称)而导致通入电极的气体通道堵塞。
②若以1.12 L.min-l(标准状况)的速率向该电池中通入二甲醚,用该电池电解500 mL2 rmol.L-1 CuS04溶液,通电0.50 min后,计算理论上可析出金属铜的质量(写出解题过程)。
“问题胶囊”事件引发了各方关注和热议,国际食品包装协会秘书长董金狮教授说:“工业明胶中重金属铬的毒性远高于三聚氰胺”。铬是严重的致癌物质,绝不允许含铬废水随意排放。请回答下列问题:
(1)三聚氰胺中N原子的杂化方式是.
(2)酸性溶液中过氧化氢能使Cr2072-生成蓝色的过氧化铬(CrO5,分子结构为 ),该反应可用来检验Cr2072-的存在。过氧化铬中铬元素的化合价为, 请写出反应的离子方程式:。
),该反应可用来检验Cr2072-的存在。过氧化铬中铬元素的化合价为, 请写出反应的离子方程式:。
(3)一种治理含Cr2072-酸性工业废水的方法是向废水中加入适量的食盐,用铁作电极进行电解,Cr2072-被还原为Cr3+,然后生成Cr(OH)3沉淀除去,以达到排放标准。
①加适量食盐的目的是,与Cr(OH)3沉淀同时生成的沉淀还可能有。
②已知电解后溶液中c(Fe3+)为4.Ox10-13mol.L-1,则溶液中c(Cr3+)浓度为。
(已知KsP[Fe(OH)3]=4.0×10-38; Ksp[Cr(OH)3]=6.0×10-31)
工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)  CH30H(g)
CH30H(g)
(1)不同温度下的平衡转化率与压强的关系如图所示。
①该反应△HO,△S0(填“>”或“<”),则该反自发进行(填“一定能”、“一定不能”、“不一定”)
②实际生产条件控制在250℃、l,3×l04kPa左右,选择此压强的理由是。
(2)某温度下,将2molCO和6mOlH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)="O.l" mol·L -1。
①该反应的平衡常数K=:
②在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有
关说法正确的是(填序号)。
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH30H)增大
③若保持同一反应温度将起始物质改为a mol CO、b mol H2、c mol CH30H,欲使平衡混合物中各组成与原平衡相同,则a、b应满足的关系为,且欲使开始时该反应向逆反应方向进行,c的取值范围是。