(13分)甲同学阅读有关资料得知:在高温下煅烧FeCO3可以得到Fe2O3。为进一步验证此结论,他做了如下实验:
(1)乙同学认为:煅烧产物可能是Fe3O4,需要检验步骤Ⅱ所得溶液中是否含有Fe2+。于是,乙同学取少量步骤Ⅱ所得溶液,向其中滴加__________溶液。确定含有Fe2+的实验现象是_______________。
(2)丙同学进一步查阅资料得知,煅烧FeCO3的产物中的确含有+2价铁元素。于是他设计了另一种由FeCO3制取Fe2O3的方法:先向FeCO3中依次加入试剂:①稀硫酸、②_____、③______;再_______(填操作名称)、灼烧,即可得到Fe2O3
(3)将FeCO3固体与足量浓硝酸反应,反应的化学方程式为____________________;若反应中生成标准状况下的11.2L气体,则转移电子的物质的量为___________________。
有X、Y、Z、W、M五种短周期元素,其中X、 Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2-
>W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法正确的是
| A.X、M两种元素只能形成X2M型化合物 |
| B.Y、Z两元素的气态氢化物中,Y的气态氢化物更稳定 |
| C.Z、W两元素的最高价氧化物对应水化物的酸性:Z > W |
| D.W、M两元素的某些单质或化合物可作为自来水消毒剂 |
已知A、B、C、D、E分别为Ca(OH)2、Ca (HCO3)2、HCl、Ba(NO3)2、Na2CO3五种溶液中的一种。现将它们相互反应情况列表如下(表中“↓”表示生成沉淀;“↑”表示生成气体; “—”表示无现象)据此可判断C是
(HCO3)2、HCl、Ba(NO3)2、Na2CO3五种溶液中的一种。现将它们相互反应情况列表如下(表中“↓”表示生成沉淀;“↑”表示生成气体; “—”表示无现象)据此可判断C是
A.HClB.Ca(HCO3)2C.Na2CO3D.Ba(NO3)2
某温度下,将Fe(OH)3(s)、Cu(OH)2(s) 分别置于蒸馏水中达到沉淀溶解平衡后,金属阳离子浓度随溶液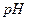 的变化如图所示。下列判断正确的是
的变化如图所示。下列判断正确的是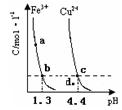
A.加适量浓NH3·H2O可使溶液由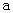 点变到 点变到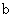 点 点 |
B.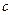 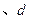 两点代表的溶液中 两点代表的溶液中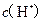 与 与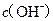 乘积不相等 乘积不相等 |
C.Cu(OH)2在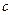 点比在d点代表的溶液中溶解程度小 点比在d点代表的溶液中溶解程度小 |
D.该温度下,氢氧化铁的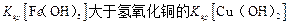 |
已知A、B、C是单质,其中C是绿色植物光合作用的产物之一,X、Y是化合物,它们之间的转化关系如图(反应条件略),下列判断不正确的是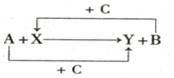
A.A 是铝,B是铁 B.A 是碳,B是硅
C.A 是氢气,B是铜 D.A 是钠,B是氢气
下列说法正确的是
| A.苯能使酸性KMnO4溶液褪色 | B.汽油、柴油和植物油都是碳氢化合物 |
| C.乙酸和油脂都能与氢氧化钠溶液反应 | D.苯在工业上主要是通过石油分馏得到 |