对于平衡体系:aA(g)+bB(g)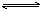 cC(g)+dD(g);正反应放热,有下列判断,其中正确的是:
cC(g)+dD(g);正反应放热,有下列判断,其中正确的是:
A.若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.45倍,则a+b>c+d
B.若从正反应开始,平衡时,A、B的转化率相等,则投入A、B的物质的量之比为 a:b
C.若平衡体系中共有气体M mol,再向其中充入bmolB,达到平衡时气体总物质的量为(M+b)mol,则a+b>c+d
D.若a+b="c+d" ,则当容器内温度上升时,平衡向左移动,容器中气体的压强不变。
药物可以预防、诊断和治疗疾病,而中学化学中不少常用化学试剂本身就具有药物的功效,如酚酞医药名为果桃, 酚酞含片是一种治疗消化系统疾病的药物,其有效成分的结构简式如图所示。下列对该有效成分的说法正确的是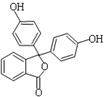
| A.所有原子可能共平面 |
| B.酚酞的水解产物中含有醇羟基 |
| C.能发生加聚反应生成高分子化合物 |
| D.1 mol该物质最多能与含4 molNaOH的烧碱溶液反应 |
下列各组有机物只用一种试剂无法鉴别的是
| A.甲苯、乙醇、溴苯 | B.苯、甲苯、环己烷 |
| C.甲酸、乙醛、乙酸 | D.苯、苯酚、己烯 |
有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同。下列事实不能说明上述观点的是:
| A.苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 |
| B.甲苯能使酸性高锰酸钾溶液褪色,乙烷不能使酸性高锰酸钾溶液褪色 |
| C.乙烯能发生加成反应,乙烷不能发生加成反应 |
| D.苯与硝酸加热时发生取代反应,甲苯与硝酸常温下就能发生取代反应 |
下列有关利用乙醛制备银镜过程的说法不正确的是
| A.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水至最初的沉淀恰好溶解为止 |
| B.将几滴银氨溶液滴入2 mL乙醛中 |
| C.将盛有乙醛与银氨溶液混合液的试管置于热水浴中加热 |
| D.在银氨溶液的配制过程中溶液pH增大 |
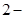 甲基
甲基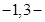 丁二烯和等物质的量的溴发生加成反应,其加成产物中二溴代烃有
丁二烯和等物质的量的溴发生加成反应,其加成产物中二溴代烃有
| A.一种 | B.二种 | C.三种 | D.四种 |