25 ℃时,弱酸的电离平衡常数如表所示,下列离子反应方程式错误的是
| 弱酸 |
H2SO3 |
HClO |
H2CO3 |
| Ka1 |
1.54×10-2 |
2.95×10-8 |
4.30×10-7 |
| Ka2 |
1.02×10-7 |
|
5.61×10-11 |
A.氯水中加入少量NaHCO3粉末:HCO3- + H+ = H2O+CO2↑
B.NaAl(OH)4溶液中通入足量的CO2:Al(OH)4-+CO2 =Al(OH)3↓+ HCO3-
C.NaClO溶液中通入少量CO2:2ClO- +H2O+CO2 = CO32- + 2HClO
D.Na2CO3溶液中通入少量SO2:2 CO32-+ H2O+ SO2 = SO32-+2HCO3-
下列离子在给定条件下一定能大量共存的是()
| A.使石蕊变红色的溶液:NH4+、Na+、Cl—、SiO32— |
| B.水电离出的c(H+)=1×10—9的溶液:Fe2+、Cu2+、SO42—、NO3— |
| C.与Al反应生成氢气的溶液:Ca2+、K+、Br—、HCO3— |
| D.使酚酞变红的溶液:Na+、K+、SO42—、ClO— |
下列有机物的命名正确的是( )
A.二溴乙烷  |
B.3 -乙基-1 -丁烯  |
C.2 -甲基-2,4-己二烯  |
D.2,4,4-三甲基戊烷 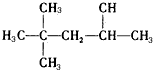 |
室温时,下列各选项中所述的两个量,前者一定大于后者的是 ( )
| A.1 L 0.3 mol/L CH3COOH溶液和3 L 0.1 mol/L CH3COOH溶液中的H+数 |
| B.pH=1的CH3COOH溶液和盐酸的物质的量浓度 |
| C.pH=12的氨水和NaOH溶液的导电能力 |
| D.等pH值的碳酸钠溶液和醋酸钠溶液的物质的量浓度 |
有机物命名时,取代基的编号必须满足“最低系列”。即当存在碳链编号不同时,得到两种或两种以上不同的编号系列,此时应顺次逐项比较各系列不同的位次,最先遇到位次编号最小者定为“最低系列”。若有多种官能团,必须按官能团的优先次序,使官能团的编号满足“最低系列”,碳碳双键比卤素原子优先。例如: 命名为1,6-二溴-1,3,5,7-环辛四烯(或简称1,6-二溴环辛四烯)则
命名为1,6-二溴-1,3,5,7-环辛四烯(或简称1,6-二溴环辛四烯)则 的命名为( )
的命名为( )
| A.1,2-二溴环辛四烯 | B.1,8-二溴环辛四烯 |
| C.2,3-二溴环辛四烯 | D.2,8-二溴环辛四烯 |
如图,图1为甲烷和O2构成的燃料电池,图2为电解MgCl2溶液装置。用该装置进行实验,反应开始后,观察到x电极附近出现白色沉淀。下列说法正确的是 ( ) 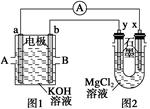
| A.A处通入的气体为O2,B处通入的气体为CH4 |
| B.电池内部K+向b极移动,OH-向a极移动 |
| C.图1装置中发生的总反应为:CH4+2O2===CO2+2H2O |
| D.图1、图2中电解质溶液的pH均增大 |