银氨溶液可用于检测CO气体,实验室研究的装置如图:
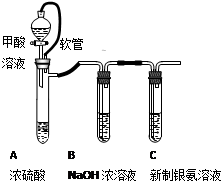 |
已知:银氨溶液制备反应为 Ag++2NH3·H2O=[Ag(NH3)2]++2H2O。 反应结束后试管C底部有黑色沉淀生成,分离出上层清液和底部黑色固体备用。 |
(1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,该反应体现浓硫酸的 (填“强氧化性”或“脱水性”)。
(2)装置A中软管的作用是 。
(3)为验证上层清液中产物的成分,进行如下实验:
a.测得上层清液pH为10。
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体。
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象。
①实验c的目的是 。
②根据上述实验现象判断,上层清液中产物成分为 (填化学符号)。
(4)设计实验证明黑色固体的成分是Ag:
可供选择的试剂有:浓硫酸、浓硝酸、NaOH溶液、NaCl溶液。
取少量上述黑色固体,用蒸馏水洗净, ,说明黑色固体是Ag单质。(补充必要的实验内容及实验现象)
(5)从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2。
①写出生成AgCl沉淀的离子反应 。
②若该反应中消耗6.6 g羟氨,理论上可得银的质量为 g。
下图是德国化学家李比希1831年测定烃类化合物(只含C、H两种元素)组成的装置。瓷盘内的烃样品经加热分解或气化后用纯O2气流驱赶经过灼热的CuO,这里烃类化合物反应变成CO2和H2O,再经吸收管吸收。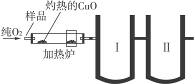
已知下列数据:
| 瓷盘 |
吸收管Ⅰ |
吸收管Ⅱ |
|||
| 瓷舟 |
样品+瓷舟 |
吸收前 |
吸收后 |
吸收前 |
吸收后 |
| A mg |
B mg |
C mg |
D mg |
E mg |
F mg |
(1)烃样品在反应过程中所用的氧化剂是________________________。
(2)吸收管Ⅰ应装的吸收剂是________,吸收管Ⅱ应装的吸收剂是________。
(3)样品中碳的质量分数的数学表达式是____________________。
(4)样品中氢的质量分数的数学表达式是____________________。
工业上制纯碱的方法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱(纯碱样品中Na2CO3的质量分数为92%~96%)。涉及到的化学方程式有: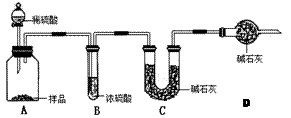
NH3+CO2+H2O → NH4HCO3,NH4HCO3+NaCl(饱和)→ NaHCO3↓+NH4Cl,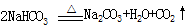 。请回答:
。请回答:
(1)工业制得的纯碱中常常含有少量的氯化钠杂质,其主要原因是。
(2)现有甲、乙、丙三个学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计如下方案,请你帮助他们完成如下实验。
甲:用(填实验仪器)称取10.0g样品,利用上图所示装置,测出反应后装置C中碱石灰增重3.52g。装置D中碱石灰的作用是。
乙:准确称取10.00g样品后,用(填实验仪器)配成1000mL溶液,用
式滴定管量取25.00mL放入锥形瓶中,加入2滴酚酞作指示剂,用0.15mol·L-1的标准盐酸溶液滴定至终点(有关反应为Na2CO3+HCl → NaCl+NaHCO3)。完成三次平行实验后,消耗盐酸体积的平均值为15.00mL。
丙:准确称取10.00g样品后,向其中加入过量的盐酸,充分反应直至样品中无气泡冒出,蒸干混合溶液将所得到固体物质于干燥器中冷却至室温后称量。反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g。请分析、计算后填表:
| 分析与计算 分组 |
计算样品中碳酸钠的质量分数 |
实验结果的评价 |
实验失败的主要原因及对结果的影响 |
| 甲 |
失败 |
||
| 乙 |
 成功 成功 |
||
| 丙 |
 成功 成功 |
(1)可以验证镁、铝的金属性强弱的实验是___________。
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将这两种元素的单质粉末分别和同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
(2)现有MgCl2溶液、AlCl3溶液、NaOH溶液、氨水、盐酸等几种物质,试设计实验方案证明镁、铝的金属性强弱。
(8分)粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验完成下列问题。
(1)实验室进行NaCl溶液蒸发时,一般有以下操作过程①放置酒精灯;②固定铁圈位置;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌;⑤停止加热。其正确的操作顺序为___________。
(2)在粗盐经过溶解、过滤后的溶液中滴加稍过量BaCl2溶液,目的是除去___________。
(3)再滴加饱和Na2CO3溶液,直至不再产生沉淀为止。请问这步操作的目的是_________________________。最后加适量盐酸将多余的Na2CO3除去。
(4)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中
都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:玻璃棒用来搅拌,加速溶解。
过滤时:______________________________________________________________________。
蒸发时:______________________________________________________________________。
试样X由FeO和CuO组成。取质量相等的两份试样按如下所示流程图进行实验: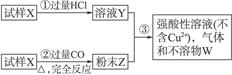
(1)请写出步骤③中所发生的全部反应的离子方程式。
(2)若全部的溶液Y和全部的粉末Z充分反应后,生成的不溶物W的质量是m,每份试样X中氧化铜的质量为__________(用m表示)。