下图是德国化学家李比希1831年测定烃类化合物(只含C、H两种元素)组成的装置。瓷盘内的烃样品经加热分解或气化后用纯O2气流驱赶经过灼热的CuO,这里烃类化合物反应变成CO2和H2O,再经吸收管吸收。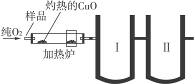
已知下列数据:
| 瓷盘 |
吸收管Ⅰ |
吸收管Ⅱ |
|||
| 瓷舟 |
样品+瓷舟 |
吸收前 |
吸收后 |
吸收前 |
吸收后 |
| A mg |
B mg |
C mg |
D mg |
E mg |
F mg |
(1)烃样品在反应过程中所用的氧化剂是________________________。
(2)吸收管Ⅰ应装的吸收剂是________,吸收管Ⅱ应装的吸收剂是________。
(3)样品中碳的质量分数的数学表达式是____________________。
(4)样品中氢的质量分数的数学表达式是____________________。
下图装置Ⅰ是实验室制乙酸乙酯的常用装置: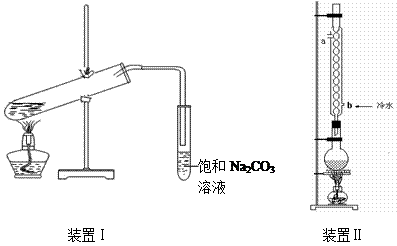
(装置1大试管口是否要加橡胶塞)
实验中所用的某些试剂及产物的相关数据如下:
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
||
| 乙醇 |
-114 |
78 |
0.789 |
||
| 乙酸 |
16.6 |
117.9 |
1.05 |
||
| 乙酸乙酯 |
-83.6 |
77.5 |
0.900 |
||
| 98%H2SO4 |
10 |
338 |
1.84 |
回答下列问题:
(1)如果用CH3CO18OH与CH3CH2OH反应,写出该反应的化学方程式(在反应物和生成物中标出18O的位置) ,浓H2SO4的作用是 。
(2)要 从装置Ⅰ中右侧小试管中分离出乙酸乙酯,应进行的操作是:撤出小试管,将混合液倒入 (填仪器名称),用力振
从装置Ⅰ中右侧小试管中分离出乙酸乙酯,应进行的操作是:撤出小试管,将混合液倒入 (填仪器名称),用力振 荡,静置, (填现象),然后将产物从_____口(填“上”或“下”)倒出。
荡,静置, (填现象),然后将产物从_____口(填“上”或“下”)倒出。
(3)采用装置Ⅱ可提高乙酸乙酯的产率,结合表格中的数据,说明该装置可提高乙酸乙酯产率的原因: 。
实验室制取乙酸乙酯的主要步 骤如下:
骤如下:
①在甲试管(如图)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液.
②按右图连接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。④分离出乙酸乙酯层、洗涤、干燥。
(1)配制该混合溶液的主要操作步骤为:__ _____________________________________;反应中浓硫酸的作
_____________________________________;反应中浓硫酸的作 用是___________________写出制取乙酸乙酯的化学方程式:___________________________________;
用是___________________写出制取乙酸乙酯的化学方程式:___________________________________;
(2)上述实验中饱和碳酸钠溶液的作用是(填字母):_______________。
A.中和乙酸和乙醇。
B.中和乙酸并吸收部分乙醇。
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出。
(3)欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器有__________;分离时,乙酸乙酯应该从仪器 ________(填:“下口放” 或“上口倒 ”)出。
”)出。
(11分)某同学用下图所示装置制取乙烯,请回答: 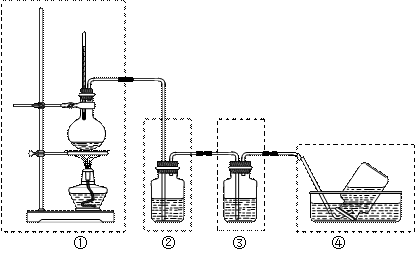
(1)在装置①~③中,有明显错误的一个装置是_____(填序号),改进方法是
。
(2)实验室制取乙烯的化学方程式为,反应类型为。
(3)配制乙醇和浓硫酸混合液的方法是。
(4)若装置②中所盛试剂为氢氧化钠溶液,则其作为。
(5)若装置③中的试剂为溴的四氯化碳溶液,观察到的现象是。
(6)实验前往往在烧瓶中加入一些碎瓷片,目的是_________________________。
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH、Cl-、CO、SO,现取两份100 mL溶液进行如下实验:
①第一份加过量NaOH溶液加热后,只收集到气体0.02 mol,无沉淀生成,同时得到溶液甲。 ②在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g。
②在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g。
③第二份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65 g。
根据上述实验回答:
(1)一定不存在的离子是__________________,不能确定是否存在的离子是__________。
(2)试确定溶液中肯定存在的离子及其浓度(可不填满):
离子符号________,浓度______________________________________________;
离子符号________,浓度______________________________________________;
离子符号________,浓度______________________________________________。
(3)试确定K+是否存在________(填“是”或“否”),判断的理由是_______________。
(12分)在烧杯里加入20 mL 0.1 mol/L的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物质的量浓度的NaHSO4溶液。实验装置如下图(夹持仪器已去掉):
实验现象如下:
①灯泡逐渐变暗;
②烧杯中有白色沉淀生成,溶液红色变浅甚至消失。
请依据实验现象回答下列问题:
(1)灯泡变暗的原因是__________________________________________________。
(2)有白色沉淀生成,说明______________________________________________,
红色变浅说明________________________________________________________。
(3)当Ba2+恰好完全沉 淀时,消耗NaHSO4溶液的体积为______ mL,溶液呈______色,离子反应方程式为_________
淀时,消耗NaHSO4溶液的体积为______ mL,溶液呈______色,离子反应方程式为_________ ___________________________________________________。
___________________________________________________。
(4)若向(3)得到的 溶液中,继续滴加NaHSO4溶液到恰好变为无色,此阶段的离子反应方程式为___________________________________________________________________。
溶液中,继续滴加NaHSO4溶液到恰好变为无色,此阶段的离子反应方程式为___________________________________________________________________。