(17分)
某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性。回答下列问题。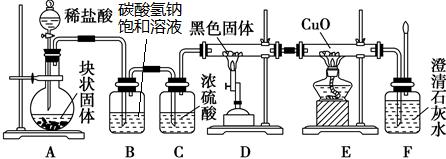
(1)写出装置A中发生反应的离子方程式:
_____________________________________________________。
(2)装置D中黑色固体为 (填名称),反应的化学方程式为:
。
(3)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是:__________________________________________________________。
(4)按照如图装置进行实验时,首先进行的操作名称是 。
(5)根据实验中的 现象,可证明CO具有还原性,有关反应的化学方程式是 。
(6)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置
与 之间连接下图中的 装置(填序号)。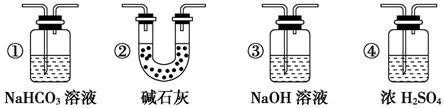
用如图所示的实验装置制备少量乙酸乙酯。请回答有关问题:
(1)试管I中盛有由2 mL浓硫酸、3 mL乙醇、2 mL冰醋酸组成的反应混合液,请简述配制该混合液的操作过程:
(2)反应中浓硫酸的作用是
(3)实验中应缓慢加热,理由是
(4)试管II中的导管口为什么要在液面之上?
(5)饱和的Na2CO3溶液的主要作用是。分离饱和的Na2CO3溶液与乙酸乙酯用到的仪器是。
(6)该实验使用的乙醇应不含水份,如何检验乙醇是否含有水份。
(7)如果乙醇含有水份,如何将其转变为无水乙醇。
氢气、纳米技术制成的金属燃料、非金属固体燃料已应用到社会生活和高科技领域。
⑴已知短周期金属元素A和B,其单质单位质量的燃烧热大,可用作燃料。其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
| A |
899.5 |
1757.1 |
14848.7 |
21006.6 |
| B |
738 |
1451 |
7733 |
10540 |
①根据上述数据分析, B在周期表中位于区,其最高价应为;
②若某同学将B原子的基态外围电子排布式写成了ns1np1,违反了原理;
③B元素的第一电离能大于Al,原因是 ;
⑵氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由。
②C60分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子相对稳定结构,则C60分子中σ键与π键的数目之比为。
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度是同族元素所形成的氢化物中最大的;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2∶1。请回答下列问题: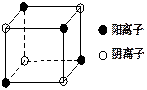
⑴A单质、B单质、化合物R的熔点大小顺序为下列的(填序号):
①A单质>B单质>R; ②R>A单质>B单质;
③B单质>R >A单质; ④A单质>R>B单质。
⑵在CB3分子中C元素原子的原子轨道发生的是________杂化,其固体的晶体类型为;
⑶写出D原子的核外价电子排布式_,C的氢化物比D的氢化物在水中溶解度大得多的可能原因
;
⑷右图是D和Fe形成的晶体FeD2最小单元“晶胞”,FeD2晶体
中阴、阳离子数之比为,FeD2物质中具有的化
学键类型为。
联氨(N2H4)是一种无色可燃的弱碱性液体,是液体大推力火箭常用的高能燃料。
⑴已知联分子中的N原子最外层满足8电子相对稳定结构,则下列说法正确的是
| A.联氨(N2H4)结构与C2H4相似,存在N=N双键 | |
| B.一分子联氨中含有的电子对数目为5 |
C.联氨中的N原子的杂化类型为sp3杂化 |
| D.联氨能与HCl发生化合反应生成N2H6Cl2 |
⑵联氨可以采用尿素[CO(NH2)2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种正盐和水,写出其反应的化学方程式;
⑶火箭推进器中分别装有联氨和过氧化氢,当它们混合时即产生气体,并放出大量热。已知:12.8 g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出256.65 kJ的热量,写出该反应的热化学方程式 。
氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制的流程:
根据上述流程回答下列问题: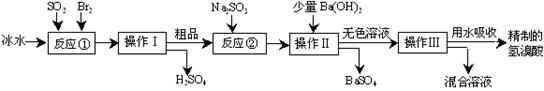 ⑴反应①中发生反应的化学方程式为;
⑴反应①中发生反应的化学方程式为;
⑵反应①中使用冰水的目的是;
⑶操作Ⅱ和操作Ⅲ的名称分别是、;
⑷反应②中加入Na2SO3的目的是;
⑸上述流程中制得的氢溴酸往往带有淡淡的黄色。请设计简单实验加以探究(包含提出假设,然后进行验证的过程)。
。