(共22分)
Ⅰ.下列实验操作中,合理的是 
| A.实验室制乙烯时,在酒精和浓硫酸的混合液中,放入几片碎瓷片,加热混合物,使液体温度迅速升到170℃ |
| B.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置,待液体分层后,滴加硝酸银溶液 |
| C.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入无水乙醇中,完成乙醇氧化为乙醛的实验 |
| D.苯酚中滴加少量稀溴水,可用来定量检验苯酚 |
E.工业酒精制取无水酒精时,先加生石灰然后蒸馏,蒸馏必须将温度计的水银球插入反应液中,测定反应液温度
Ⅱ.实验室用下图所示装置制备溴苯,并验证该反应是取代反应。
(1) 关闭F活塞,打开C活塞,在装有少量苯的三颈瓶中由A口加入少量溴,再加入少量铁屑,塞住A口,则三颈瓶中发生反应的化学方程式为: 。
(2) D试管内装的是 ,其作用是 。
(3) E试管内装的是 ,E试管内出现的现象为 。
(4) 待三口烧瓶中的反应即将结束时(此时气体明显减少),打开F活塞,关闭C活塞,可以看到的现象是 。
(5) 上一步得到粗溴苯后,要用如下操作精制:
a蒸馏; b水洗; c用干燥剂干燥; d 10%NaOH溶液洗涤; e水 洗
洗
正确的操作顺序是
Ⅲ.用如右图所示装置进行实验,将A逐滴加入B中:
(1) 若B为Na2CO3粉末,C为C6H5ONa溶液,实验中观察到小试管内溶液由澄清变浑浊,则试管C中化学反应的离子方程式:________________ 。然后往烧杯中加入沸水,可观察到试管C中的现象: 。
(2) 若B是生石灰,观察到C溶液中先形成沉淀,然后沉淀溶解.当沉淀完全溶解,恰好变澄清时,关闭E.然后往小试管中加入少量乙醛溶液,再往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则A是 (填名称),C是 (填化学式),与乙醛的混合后,该溶液中反应的化学方程式: _____________。仪器D在此实验中的作用是 。
某课外兴趣小组为探究某种铝合金(含Mg Al)中铝含量,设计如图装置进行实验。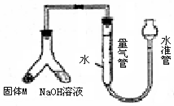
(1)如何检验该装置的气密性
(2)样品与氢氧化钠溶液反应的离子方程式:。
(3)使足量氢氧化钠溶液与ag合金(固体M)充分反应,进入量气管的气体体积为VmL
(已换算成标准状况,下同)。若a=0.036,V=22.4,该合金中铝的质量分数是。
(4)若将装置中的氢氧化钠替换为足量的盐酸,与ag合金粉末充分反应,则进入量气管内的气体体积(填“>”“<”“=”)VmL;利用此方法测得的气体体积能否进行铝的含量计算?(填“能”或“否”)
⑴有一学生在实验室测某溶液pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。
①这种错误操作(填“一定”/“一定不”/“不一定”)会导致实验结果有误差。
②若按此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是。
⑵、用已知浓度的 NaOH 溶液测定某 HCl溶液的浓度,参考右图,从表中选出正确序号 _____________
| 序号 |
锥形瓶中溶液 |
滴定管中溶液 |
选用指示剂 |
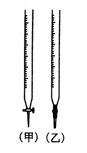 选用滴定管 选用滴定管 |
| A |
碱 |
酸 |
石芯 |
(乙) |
| B |
酸 |
碱 |
酚酞 |
(甲) |
| C |
碱 |
酸 |
甲基橙 |
(甲) |
| D |
酸 |
碱 |
酚酞 |
(乙) |
⑶、用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是。
A. 配制标准溶液的氢氧化钠中混有Na2CO3杂质
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E. 未用标准液润洗碱式滴定管
⑷、已知滴定管中装有浓度为0.112mol/L的盐酸。逐滴加入到装有氢氧化钠的溶液的锥形瓶中。开始时读数及恰好反应时盐酸的读数见下表。
| 实验 编号 |
待测氢氧化钠溶液体积(mL) |
滴定开始读数(mL) |
滴定结束读数(mL) |
消耗盐酸体积(mL) |
| ① |
25.00 |
0.02 |
26.40 |
|
| ② |
25.00 |
0.04 |
25.81 |
|
| ③ |
25.00 |
0.03 |
25.78 |
|
| ④ |
25.00 |
0.20 |
25.96 |
试计算待测的氢氧化钠的物质的量浓度=.
实验室常用苯甲醛在浓氢氧化钠溶液中制备苯甲醇和苯甲酸,反应式如下: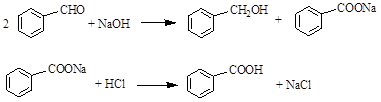
已知:①苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、0.95g(60℃)、6.8g(95℃)
②乙醚沸点34.6℃,密度0.7138,易燃烧,当空气中含量为1.83%~48.0%时易发生爆炸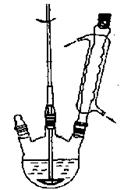
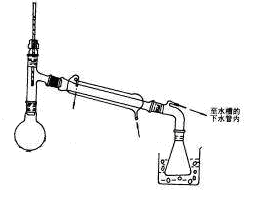
图1制备苯甲酸和苯甲醇的反应装置图图2蒸乙醚的装置图
实验步骤如下:
①向图1所示装置中加入8g氢氧化钠和30mL水,搅拌溶解。稍冷,加入10 mL新蒸过的苯甲醛。开启搅拌器,调整转速,使搅拌平稳进行。加热回流约40 min。
②停止加热,从球形冷凝管上口缓缓加入冷水20mL,摇动均匀,冷却至室温。反应物冷却至室温后,倒入分液漏斗,用乙醚萃取三次,每次10mL。水层保留待用。合并三次萃取液,依次用5 mL饱和亚硫酸氢钠溶液洗涤,10mL 10%碳酸钠溶液洗涤,10 mL水洗涤。
③分出醚层,倒入干燥的锥形瓶,加无水硫酸镁,注意锥形瓶上要加塞。将锥形瓶中溶液转入图2所示蒸馏装置,缓缓加热。升高温度蒸馏,当温度升到140℃时改用空气冷凝管,收集198℃~204℃的馏分得产品A。将萃取后的水溶液慢慢地加入到盛有30 mL浓盐酸和30 mL水的混合物中,同时用玻璃棒搅拌,析出白色固体。冷却,抽滤,得到粗产品,然后提纯得产品B。
根据以上步骤回答下列问题:
(1)步骤①中所加的苯甲醛为什么要是新蒸的?_____________________________________。
(2)步骤②萃取时用到的玻璃仪器除了除烧杯、玻璃棒外,还需______________________,饱和亚硫酸氢钠溶液洗涤是为了除去__________________,而碳酸钠溶液洗涤是为了除去醚层中极少量的苯甲酸。
(3)步骤③中无水硫酸镁的作用是_________________,将锥形瓶中溶液转入图2所示蒸馏装置时涉及的实验操作为__________________。
(4)产品A为____________,蒸馏除乙醚的过程中采用的加热方式为_______________,提纯产品B所用到的实验操作为________________。
尖晶石型锰酸锂(LiMn2O4)是一种环保绿色能源新型材料。实验室通过下列方法制取:将MnO2和Li2CO3按4︰1的物质的量比配料,球磨3~5小时,然后升温至600℃~750℃,保温24小时,自然冷却至室温得产品。
(1)保温24小时的目的是____________________________________________________。
(2)写出该反应的化学方程式_________________________________________________。
(3)实验室测定锰酸锂中锰的平均化合价的实验步骤如下:
步骤1:准确称取0.1g左右的尖晶石型锰酸锂试样于锥形瓶中,加入5mL稀硫酸、10.00mL 0.2000mol/L草酸钠(Na2C2O4)标准溶液,于80℃水浴加热溶解;
步骤2:待试样全部溶解,立即用浓度为0.2000mol/L的高锰酸钾溶液滴定至终点;
步骤3:计算样品得电子的物质的量n;
步骤4:将溶液中Mn2+氧化为Mn3+,再用硫酸亚铁铵标准溶液滴定,记录实验数据,计算出样品中Mn元素的质量为m;
步骤5:将实验步骤1-4重复2次。
已知反应: 2Mn3++C2O42-=2Mn2++2CO2↑;Mn4++C2O42-=Mn2++2CO2↑
2MnO4-+5C2O42-+16H+="2" Mn2++10 CO2↑+8H2O
①步骤2中,为判断滴定终点,_________(填“需要”或“不需要”)加入指示剂。
②步骤4中,滴定时盛放硫酸亚铁铵标准溶液的玻璃仪器是___________________。
③请用样品得电子的物质的量n和样品中Mn元素的质量m来表示样品中Mn元素的化合价=_____。
实验室有NH4HCO3和NaHSO3的干燥粉状混合物,某兴趣小组为测定其中NH4HCO3的含量,设计了用在混合物中加酸的实验方法来测定其质量分数。回答以下问题:
⑴化学小组主要选用了下列药品和仪器进行实验。(图中每种仪器装置只选用了一次,铁架台等固定仪器未画出)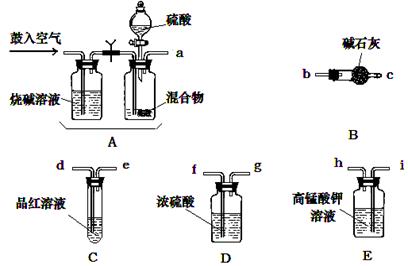
请按气流由左向右的方向,仪器连接顺序是(填仪器的接口字母a、b...)
a→→→→→ f →g → →。
⑵实验开始,混合物加酸前,A装置需要鼓入空气,作用是;加酸后A装置再次鼓入空气的作用是。
⑶ E装置的作用是。
⑷实验中,若C瓶中溶液褪色,则测定结果可能会偏(填“高”或“低”)。为了确
保实验中C瓶溶液不褪色,若取样品的质量为m g,实验前 E中所装 a mol·L-1的KMnO4
溶液体积(V)不少于mL。
⑸若混合物样品质量为13.1g,充分作用后碱石灰增重4.4g,则混合物中NH4HCO3的质
量分数为。
⑹从定量测定的准确性考虑,该套装置还应作进一步的改进是。
可能用到的相对原子质量:H~1 C~12 N~14 O~16 Na~23 S~32