稀土是工业味精,邓小平同志说过“中东有石油,我们有稀土”。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是 ( )
| A.电解熔融CeO2制Ce,铈在阳极获得 |
B.铈有四种稳定的核素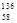 Ce、 Ce、 Ce、 Ce、 Ce、 Ce、 Ce,它们互为同素异形体 Ce,它们互为同素异形体 |
| C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+ |
| D.由于氧化性:Ce4+>Fe3+,而I—有强还原性,所以铈溶于氢碘酸的化学方程式可表示为:2Ce+6HI=2CeI3+3H2↑。 |
下列各溶液中,微粒的物质的量浓度关系正确的是
| A.0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) |
| B.0.1 mol/L NaHCO3溶液:c(OH-)+ c(CO32-)=c(H+)+c(H2CO3) |
| C.0.3mol/L和0.1mol/L的两醋酸溶液中H+离子浓度之比为3 :1 |
| D.25℃时,pH=4.75,浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液: |
c(CH3COO-) + c(OH-) < c(CH3COOH) + c(H+)
有①NaOH溶液、②Na2CO3溶液、③CH3COONa溶液各10mL,物质的量浓度均为0.1mol·L-1,下列说法正确的是
| A.三种溶液pH的大小顺序是①>③>② |
| B.三种溶液中由水电离出的OH-浓度的大小顺序是①>②>③ |
| C.若将三种溶液稀释相同倍数,pH变化最大的是③ |
| D.若分别加入10mL 0.1mol·L-1盐酸后,pH最大的是② |
若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈碱性,其原因可能是
| A.生成了一种弱酸强碱盐 | B.弱酸溶液和强碱溶液反应 |
| C.强酸溶液和弱碱溶液反应 | D.一元强酸溶液和二元强碱溶液反应 |
如下图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O
下列说法正确的是
| A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 |
| B.甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O=CO32-+8H+ |
| C.反应一小段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 |
| D.甲池中消耗560 mL(标准状况下)O2,此时丙池中理论上最多产生2.9g固体 |
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法正确的是
| A.电池放电时Na+从b极区移向a极区 |
| B.电极b采用MnO2,MnO2既作电极材料又有催化作用 |
| C.该电池的负极反应为:BH4-+8OH-+8e-→BO2-+6H2O |
| D.每消耗3 mol H2O2,转移的电子为3 mol |