选用如下实验装置组合后完成用浓盐酸、二氧化锰共热制Cl2,并用Cl2和Ca(OH)2反应制少量漂白粉的实验。已知①工业制漂白粉反应为放热反应。②温度稍高即发生副反应6Cl2+6Ca(OH)2==5CaCl2+Ca(ClO3)2+6H2O。
⑴选用各装置的接口顺序为 (填图中小写英文字母)。
⑵制漂白粉的装置选择 (填C或D)装置的原因
。
F装置的作用是
写出F中发生反应的化学方程式
⑶实验中若用12mol﹒L-1的浓盐酸100mL与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总是小于0.15mol,其可能的主要原因是
(假定各步反应均无反应物损耗且无副反应发生)。
在标准状况下,将224LHCl气体溶于635mL水中(水的密度为1 g/cm3)
所得盐酸的密度为1.18g/cm3,回答下列问题:
(1)该盐酸溶液的质量分数为;该盐酸溶液的物质的量浓度为。
(2)实验室利用该盐酸来配制250mL0.5mol/L的稀盐酸,从下列用品中选出实验所需要的仪器或用品______________(填序号)
a .胶头滴管b.10mL量筒c.20mL量筒 d. 100mL容量瓶
.胶头滴管b.10mL量筒c.20mL量筒 d. 100mL容量瓶
e.玻璃棒f.1000mL容量瓶 g.广口瓶 h.托盘天平
除选用上述仪器外,尚缺少的仪器或用品是__ ______。需取用原盐酸mL。
(3)下列操作对所配溶液的浓度有何影响?(答偏高、偏低、无影响)
①转移一次后,将洗涤烧杯的残液倒入废液缸中:。
②定容时仰视容量瓶:。
③定容后,加盖倒转摇匀后观察,发现液面低于刻度线: 。
。
用18 mol/L 的浓硫酸配制100 ml 3.0 mol/L 稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积②量取一定体积的浓硫酸③溶解
④检漏 、转移、洗涤⑤定容、摇匀
、转移、洗涤⑤定容、摇匀
回答下列问题:
(1)所需浓硫酸的体积是,量取浓硫酸所用的量筒的规格是(用下列编号填空)。
| A.10ml | B.25ml | C.50ml | D.100ml) |
(2)第③步实验的操作是
(3)第⑤步实验的操作是继续向容量瓶中注入蒸馏水至离刻度线;改用向容量瓶中滴加蒸馏水至为止。塞紧瓶塞,倒转摇匀并装试剂瓶。
(4)检验试剂瓶中的溶液含有SO42-的操作是
(5)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
①容量瓶用蒸馏水洗涤后残留有少量的水;
②所用过的烧杯、玻璃棒未洗涤;
③加水超过刻度线后,用胶头滴管吸出多余的液体。
实验室要配制100 mL 0.5 mol·L-1的NaCl溶液,试回答下列各题:
(1)下列仪器中,肯定不会用到的是 ()
A.锥形瓶 B.200 mL容量瓶 C.量筒 D.胶头滴管 E.100 mL容量瓶 F.天平
(2)若要实施配制,除上述仪器外,还缺少的仪器或用品是____________________。
(3)容量瓶上除有刻度线外还应标有_________________,容量瓶在使用前必须进行的一步操作是_________________________。
(4)配制完毕后,老师指出有四位同学各进行了下列某一项错误操作,你认为这四项错误操作会导致所得溶液浓度偏高的是( )
A.定容时仰视容量瓶刻度线 B.定容时俯视容量瓶刻度线
C.将溶解冷却后的溶液直接转入容量瓶后就进行定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
(5)通过计算可得出可用托盘天平称取NaCl固体________克。若用4 mol/L的NaCl浓溶液配制100 mL 0.5 mol·L-1的稀溶液,应用量筒量取_________mL该浓溶液。
(7分) 右图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。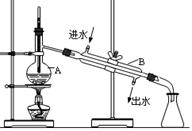
(1)图中的两处明显的错误是
①;②。
(2)A仪器的名称是____________,
B仪器的名称是_______________。
(3)实验时A中除加入少量自来水外,为防止 液体暴沸还需加入少量_______。
某中学化学宴验小组为了证明和比较SO2和氯水的漂白性,设计了如下装置:
(1)实验室常用装置E制备Cl2(用浓盐醴跟MnO2反应),指出该反应中浓盐酸所表现出的性质。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色.停止通气后,给B、D两个试管加热.两个试管中的现象分别为:BD
(3)装置C的作用是
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:
在气体进人品红溶液之前,先将SO2和Cl2通过浓硫酸,目的是干燥SO2和Cl2并使其混合均匀,通过观察气泡控制气体的流速。通气一段时间后.甲同学宴验过程中发现品红溶液几乎不褪色.而乙同学的实验现象是品红溶液随时问的推移变得越来越浅。试根据激宴验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是:。(结合离子方程式说明)
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?。