煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。已知CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
830 |
1 000 |
| 平衡常数K |
10 |
9 |
1 |
0.6 |
试回答下列问题:
(1)上述反应的正反应是____反应(填“放热”或“吸热”),该反应的平衡常数表达式为 。
(2)能判断该反应是否达到化学平衡状态的依据是 (填序号)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(3)在实际生产中,该反应的适宜条件为 .
A.加压,400~500℃ 催化剂 B.加压,830~1000℃ 催化剂
C.常压,400~500℃ 催化剂 D.常压,830~1000℃ 催化剂
(4)在830 ℃时,2L的密闭容器中加入4molCO(g)和6molH2O(g),10 min后达到平衡时,CO2的平衡浓度为___________,用H2浓度变化来表示的平均反应速率为____________, CO的转化率是_________。
(5)为使该反应的反应速率增大且平衡向正反应方向移动的是___________(填字母序号).
a.增大CO浓度 b.升高温度
c.将生成物分离出去 d.使用高效催化剂
(每空2分,共10分。)
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。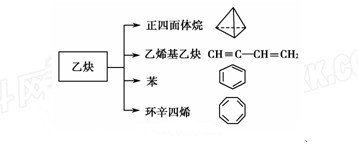
完成下列各题:
(1) 正四面体烷的二氯取代产物有________种。
正四面体烷的二氯取代产物有________种。
(2)关于乙烯基乙炔分子的说法错误 的是________。
的是________。
a.能使酸性KMnO4溶液褪色
b.1 mol乙烯基乙炔能与3 mol Br2发生加成反应
c.乙烯基乙炔分子内含有两种官能团
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举一例)________________。
(4)写出与环辛四烯互为同分异构体且属于芳香烃的物质发生加聚反应的反应方程式_______________。
(5)乙烯基乙炔可与HCl反应生成2-氯-1,3-丁二烯,写出2-氯-1,3-丁二烯加聚反应的反应方程式_______________。
(每空1分,共13分。)
(1)选择下列某种答案的序号,填入下表的空格。
①同位素②同素异形体③同分异构体④同系物⑤同种物质
| 物质 |
红磷 |
氯仿与 |
氕与 |
新戊烷与 |
2-甲基戊烷与 |
| 名称 |
与白磷 |
三氯甲烷 |
氘、氚 |
2,2-二甲基丁烷 |
2,3-二甲基丁烷 |
| 相互关系 |
(2)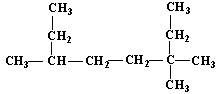 的名称为___________________________;
的名称为___________________________;
( 3)
3) 的名称为____________________________;
的名称为____________________________;
(4)2,4-二氯甲苯的结构简式为___________________________;
(5)反-2-戊烯的结 构简式为________________________________;
构简式为________________________________;
(6)某物质结构如图所示,其官能团是,;分子式为;
该物质可以与下列(填序号)发生反应。
A.酸性KMnO4溶液 B.氢气 C.溴水 D.NaOH溶液
B.氢气 C.溴水 D.NaOH溶液
如何防止铁的锈蚀是工业上研究的重点内容。为研究铁的锈蚀,某同学做了探究实验,如下图所示,铁处于①、②、③三种不同的环境中。请回答: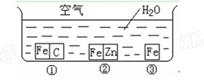
(1)铁被腐蚀的速率由快到慢的顺序是(填序号)。
(2)铁处于①环境时,正极反应式___________________________
(3)请你为以下钢铁制品选择适当的防锈方法。
A.自行车的链条、齿轮
B.海水中的轮船
环境和材料是现在社会中两大关注的问题,请回答:
(1)室内空气污染物主要包括CO、CO2、HCHO(甲醛)、C6H6(苯)等,在这四种污染物中,由建筑和装修产生的是_____________________。
(2)造成水体富营养化的主要原因是。
A.汞(Hg)、镉(Cd) B.N、P的化合物
C.石油泄漏 D .工厂
.工厂 排放酸、碱、盐
排放酸、碱、盐
(3)造成白色污染的主要原因是。
A.废塑料制品 B.废铝制易拉罐
B.废旧电池 D.生活垃圾
(4)为了治理汽车尾气的污染问题,可以在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成CO2和N2,写出该反应的化学方程式:。
(5)合金是被广泛应用的金属材料,下列有关合金性质的说法正确的是(填字母)
A.合金的熔点一般比它的成分金属高
B.合金的硬度一般比它的成分金属低
C.组成合金的元素种类 相同,合金的性能就一定相同
相同,合金的性能就一定相同
D.合金与各成分金属相比,具有许多优良的 物理、化学或机械性能
物理、化学或机械性能
(6)塑料、合成橡胶和是常说的三大合成材料。
随着生活水平的提高,人们越来越 关注自身的健康。请回答:
关注自身的健康。请回答:
(1)蛋白质是构成生命的基础物质,是日常膳食的重要组成部分。下列食物中富含蛋白质的是 。
A.苹果 B.白菜C.牛奶 D.米饭
(2)人体所需的营养物质中,水解后能生成高级脂肪酸和甘油的是;蛋白质水解的最终产物是;提纯蛋白质可以采用的一种方法是(填“盐析”或“过滤”)。
(3)向淀粉溶液中加入碘水 ,溶液呈色,再往该溶液中滴加维生素C溶液,现象是,该实验说明了维生素C具有性。下列有关维生素C说法不正确的是。
,溶液呈色,再往该溶液中滴加维生素C溶液,现象是,该实验说明了维生素C具有性。下列有关维生素C说法不正确的是。
A.蔬菜应先洗后切 B.蔬菜应小火慢煮 C.维生素C可使溴水褪色
(4)抗酸药物的种类很多,其有效成分一般都是碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁等化学物质。某品牌抗酸药的主要成分有糖衣、碳酸镁、氢氧化铝、淀粉。
写出该抗酸药发挥功效时的离 子方程式:
子方程式:
、。