实验室用 98%、密度为1.84g/cm3的浓硫酸配制0.2mol/L的 H2SO4溶液950mL.
(1)需要使用的主要仪器有量筒、烧杯、玻棒、 、 。
(2)其操作步骤可分解为以下几步:
A.用量筒量取 mL浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌。
B.用适量蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都移入容量瓶里。
C.将稀释后的硫酸小心地用玻璃棒引流容量瓶里。
D.检查容量瓶是否漏水。
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1-2cm处。
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液。
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切。
请据此填写:
①完成上述步骤中的空白处。
②补充完成正确的操作顺序(用字母填写):
( D)→( A )→( C )→( )→( )→( )→( F )。
③容量瓶在使用前必须进行的操作是 。
④将浓硫酸在烧杯中稀释后移入容量瓶时,必须_____________方可移液.
(3)试分析下列操作对所配溶液的浓度有何影响
①量取浓硫酸时眼睛俯视刻度线,会导致所配溶液浓度会 ;(填: 偏高、偏低、或无影响,下同)
②定容时,眼睛俯视刻度线,所配溶液浓度会 ;
③定容后,加盖倒转摇匀后,发现溶面低于刻度线,又滴加蒸馏水至刻度,所配溶液浓度会 .
④容量瓶未干燥即用配制溶液 .
⑤往容量瓶转移时,有少量液体溅出 .
实验室用燃烧法测定三聚氰胺(CxHyNp)的分子组成.取一定质量的三聚氰胺放在纯氧中充分燃烧,生成CO2、H2O和N2.实验装置如题29图所示(假设每步都完全反应)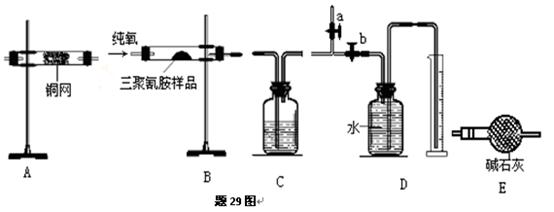
请回答下列问题:
(1)装置的连接顺序是接接接接(填字母).
(2)装置C中盛装的试剂是.
(3)实验开始时,首先打开止水夹a,关闭止水夹b,通一段时间的纯氧,这样做的目的是
.
(4)以上装置中需要加热的有(填装置字母代号),操作时应先点燃处的酒精灯.
(5)装置A的作用是.
(6)实验中测得氮气的体积(折算到标况下),生成CO2的质量和水的质量,为了确定三聚氰胺的分子式,还需要的数据是.
为了证明化学反应有一定的限度,进行了如下探究活动:
(Ⅰ)取5mL0.1 mol·L-1的KI溶液,滴加0.1 mol·L-1的FeCl3溶液5~6滴
(Ⅱ)继续加入2mLCCl4振荡
(Ⅲ)取萃取后的上层清液,滴加KSCN溶液
(1)探究活动(Ⅰ)和(Ⅱ)的实验现象分别为_____________、。
(2)在探究活动(Ⅲ)中,活动设计者的意图是通过生成血红色的Fe(SCN)3,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中,却未见溶液呈血红色,对此同学们提出了下列两种猜想。
猜想一:Fe3+已全部转化为Fe2+
猜想二:生成Fe(SCN)3浓度极小,其颜色肉眼无法观察
为了验证猜想,在查阅资料后,获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高
结合新信息,请你设计以下实验验证猜想
①请将相关的实验操作、现象和结论填入下表
| 实验操作 |
现象 |
结论 |
| 步骤一: |
产生蓝色沉淀 |
|
| 步骤二: |
“猜想二”成立 |
②写出操作“步骤一”中发生反应的离子方程式
Ⅰ.下图为常见仪器的部分结构(有的仪器被放大)
图A中液面所示溶液的体积为mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为n mL,仰视时读数为m mL,若m>n,则所使用的仪器是(填字母标号)。
Ⅱ.某学生用标准0.25 mol·L—1 NaOH溶液滴定硫酸的实验操作如下:
| A.用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入指示剂。 | |
| B.用待测定的溶液润洗酸式滴定管。 | C.用蒸馏水洗干净滴定管。 |
| D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。 |
E.检查滴定管是否漏水。 F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填): 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终?。
④碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”),原因是。
⑤假设操作均正确,标准液消耗了22.18mL,计算待测硫酸溶液的物质的量浓度(计算结果精确到小数点后二位)mol·L—1
Ⅲ.已知常温时醋酸的电离常数为1.8×10-5,一水合氨的电离常数为1.8×10-5。在少量Mg(OH)2悬浊液中,滴加适量饱和NH4Cl溶液,固体溶解。对于固体的溶解。
甲同学认为在氢氧化镁悬浊液中存在下列平衡:
Mg(OH)2 Mg2+ +2OH-
Mg2+ +2OH-
加入NH4Cl溶液,由于NH4+水解产生H+中和了Mg(OH)2电离产生的OH-而使平衡右移导致Mg(OH)2 溶解。
而乙同学却认为NH4Cl电离产生的NH4+结合了OH-生成了弱电解质NH3·H2O,使c(OH-)减小,平衡右移而导致Mg(OH)2 溶解。设计方案评价甲乙两位同学的观点:
___________________________________________________________________
_________________________________________________________________________
化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫与二氧化碳,老师启发他们并由他们自己设计了下列实验图以确认上述混合气体中有C2H4、CO2和SO2。回答下列问题:
(1)I、II、III、IV装置可盛放的试剂是I;II;III;IV(将下列有关试剂的序号填入空格内)。
A.品红溶液 B.Ca(OH)2溶液 C.溴水溶液
(2)能说明SO2气体存在的现象是。
(3)使用装置III的目的是。
(4)使用装置IV的目的是。
(5)确定含有乙烯的现象是。
(6)请写出II装置发生的化学方程式、。
喹硫平可用于精神疾病的治疗,其结构为: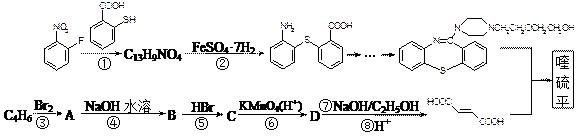
(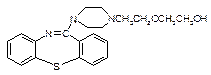 )2·
)2·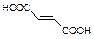 ,它的合成路线如下:
,它的合成路线如下:
已知:(Ⅰ)反应①为取代反应;(Ⅱ)A的系统命名为1,4-二溴―2―丁烯。
请回答下列问题:
⑴写出分子式为C13H9NO4S的物质的结构简式。
⑵物质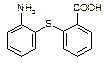 中除硫醚键(-S-)外,还含有的官能团名称为。
中除硫醚键(-S-)外,还含有的官能团名称为。
⑶反应③的类型是反应,反应⑤的目的是。
⑷写出反应④的化学方程式。
⑸物质B的同分异构体有多种,其中既含有羟基,又含有醛基的同分异构体有种。
⑹已知:-SH的性质与-OH相似。
物质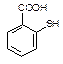 一定条件下形成聚合物的结构简式为。
一定条件下形成聚合物的结构简式为。