反应SiCl4 + 2H2 =Si(纯) + 4HCl 可用于工业上制取纯硅。该反应属于
| A.置换反应 | B.复分解反应 | C.化合反应 | D.分解反应 |
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为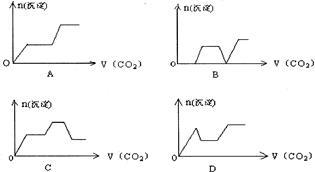
根据碘与氢气反应的热化学方程式:
①I2(?)+H2(g) 2HI(g) ΔH="-9.48" kJ·mol-1
2HI(g) ΔH="-9.48" kJ·mol-1
②I2(?)+H2(g) 2HI(g) ΔH="+26.48" kJ·mol-1
2HI(g) ΔH="+26.48" kJ·mol-1
下列判断中正确的是
| A.①中的I2为固态,②中的I2为气态 |
| B.254 g I2(g)完全反应放热9.48 kJ |
| C.①的产物比②的产物热稳定性更好 |
| D.1 mol固态碘升华时将吸热17 kJ |
下列叙述正确的是
①任何化学反应都有反应热 ②化合物MgO、SiO2、Al2O3中化学键的类型相同 ③有些化学键断裂时吸收能量,有些化学键断裂时放出能量 ④PH3分子稳定性和沸点均低于NH3分子 ⑤O3和NO2都是共价化合物 ⑥有热量变化的过程一定有化学键的断裂与形成 ⑦单质中不可能有离子键 ⑧有化学键断裂的变化属于化学变化
| A.①④⑦ | B.②③ | C.③⑤ | D.②⑤⑥ |
下列反应的离子方程式正确的是
| A.向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3↓+H+ |
| B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+= Fe3++3H2O |
| C.向含有0.4 mol FeBr2溶液中通入0.3 mol Cl2充分反应:4Fe2++2Br﹣+3Cl2= 4Fe3++6Cl﹣+Br2 |
D.用Pt电极电解饱和氯化镁溶液:2Cl﹣+2H2O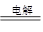 H2↑+Cl2↑+2OH﹣ H2↑+Cl2↑+2OH﹣ |
设NA为阿伏加德罗常数的值,下列叙述中正确的是
| A.常温下,含l mol Fe的铁片与过量浓HNO3反应,转移电子的数目为3 NA个 |
| B.电解饱和食盐水,当阴极产生2.24LH2时,转移的电子数为0.2NA |
| C.标准状况下,33.6 L SO3含有9.03×1023个SO3分子 |
| D.在46 gNO2和N2O4的混合物气体中所含原子总数为3NA个 |