在如图所示的三个容积相同的三个容器①、②、③进行如下的反应:3A(g)+B(g) 2C(g)△H<0
2C(g)△H<0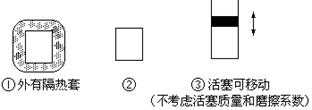
(1)若起始温度相同,分别向三个容器中充入3mol A和1mol B,则达到平衡时各容器中C物质的百分含量由大到小的顺序为 (填容器编号)
(2)若维持温度不变,起始时②中投入3mol A、1mol B; ③中投入3mol A、1mol B和2mol C,则达到平衡时,两容器中B的转化率② ③(填<、>或=)
(3)若维持②③容器内温度和压强相等,起始时在②中投入3molA和1molB,在③中投入amol A和bmol B及cmol C,欲使达平衡时两容器内C的百分含量相等,则两容器中起始投料量必须满足(用含a、b、c的关系式表达):
(1)已知下列两个热化学方程式:
C3H8(g)+5O2(g) =3CO2(g)+4H2O(l)ΔH=-2220.0 kJ·mol-1
H2O(l)=H2O(g)ΔH="+44.0" kJ·mol-1
则0.5 mol丙烷燃烧生成CO2和气态水时释放的热量为___________。
(2)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如下图所示),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN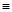 N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
(3)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:
2H2+O2=2H2O,电解质溶液为稀H2SO4溶液,电池放电时是将_________能转化为___________能。其电极反应式分别为:
负极_________________________,正极_____________________________。
某温度时,在一个容积为2 L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白: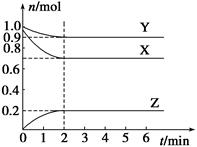
(1)该反应的化学方程式为_______________;
(2)反应开始至2 min,气体Z的反应速率为____________;
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的________倍;
②若此时将容器的体积缩小为原来的 0.5倍,达到平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为________反应(填“放热”或“吸热”)。
按下图所示装置进行实验,并回答下列问题: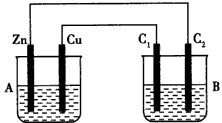

(1)判断装置的名称:A池为__________________,B池为________________________。
(2)铁极为_________极,电极反应式为________________________;铜极为________极,电极反应式为________________________ ;石墨棒C1为_______极,电极反应式为____________________________;石墨棒C2附近发生的实验现象为________,反应结束后,B池溶液的pH值________。(增大、减小、不变,忽略气体溶于水)
(3)当C2极析出224 mL气体(标准状况下),铁的质量________(增加或减少)__________g
将11.2g铁投入200mL某浓度的盐酸中,铁和盐酸恰好完全反应。求:
(1)所用盐酸中HCl的物质的量浓度
(2)反应中生成的H2在标准状况下的体积
(3)在反应后的溶液中通入Cl2,写出所发生反应的化学方程式并用双线桥标出电子转移的方向和数目:
有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、Ba(NO3)2、K2CO3、K2SO4中的一种或几种,现按下列步骤进行实验。
(1)将该粉末溶于水得无色溶液和白色沉淀。
(2)在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体。
(3)取滤液做焰色反应,可证明滤液中含Na+,不含K+。
由上述现象推断:
(1)该混合物中一定含有 ;一定不含有,可能含有。
(2)如要对可能含有的物质进行检验,如何操作: