氨是重要的氮肥,合成原理为:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ/mol。回答下列问题:
2NH3(g) ΔH=-92.4 kJ/mol。回答下列问题:
(1)写出平衡常数K的表达式______________,如果降低温度,该反应K值________,化学反应速率________,N2的转化率________(填“增大”、“减小”或“不变”)。
(2)在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各种物质的量变化如图所示,回答下列问题:
①10 min内以NH3表示的平均反应速率:_________________________。
②在10~20 min内:NH3浓度变化的原因可能是( )
| A.加了催化剂 | B.缩小容器体积 |
| C.降低温度 | D.增加NH3物质的量 |
③第1次平衡的时间为:____________,第2次平衡的时间为:____________,第1次平衡:平衡常数K1=___________________ (带数据的表达式),第2次平衡时NH3的体积分数__________;
④在反应进行至25 min时,曲线发生变化的原因: ______________________________________,
达第二次平衡时,新平衡的平衡常数K2 K1,(填“大于”、“小于”或“等于”)。
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)≒2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=。
已知:K(300℃)>K(350℃),该反应是_。
(2)如图中表示NO2的变化的曲线是。
用O2表示从0~2s内该反应的平均速率v=。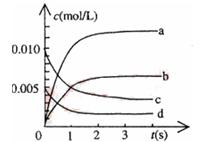
(3)能说明该反应已达到平衡状态的是。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正 (O2) d.容器内密度保持不变[
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
合成氨是人类科学技术发展史上的一项重大突破。合成氨反应的化学方程式为N2(g)+3H2(g)≒2NH3(g)。一定条件下,在密闭容器中反应达平衡后,请回答:
(1)若增大N2的浓度,则化学反应速率(填“增大”或“减小”),化学平衡
(填“向正反应方向”、 “向逆反应方向”或“不”)移动,N2的转化率_________。
“向逆反应方向”或“不”)移动,N2的转化率_________。
(2)若加入适当的催化剂,则化学反应速率增大,化学平衡(填“向正反应方向”、“向逆反应方向”或“不”)移动。
(3)若减压时,N2的质量分数_________。(填“增大”“减小”或“不变”,)
(4)从化学平衡移动的角度分析,提高H2转化率可以采取的措施是 (选填序号字母)。
(选填序号字母)。
a、及时分离出NH3 b、升高温度 c、增大压强 d、使用催化剂
(5)写出该反应的化学平衡常数表达式:K= 。
已知下列热化学方程式:
① H2(g) + 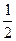 O2(g) = H2O(l)△H = -285.8 kJ / mol
O2(g) = H2O(l)△H = -285.8 kJ / mol
② C(s) + O2(g) = CO2(g)△H = -393.5 kJ / mol
③ C(s) + H2O(g) =" CO(g)" + H2(g)△H = +131.5 kJ/mol
请回答:
(1)上述反应中属于放热反应的是(填序号,下同),属于吸热反应的是。
(2)1 mol H2完全燃烧生成液态水,放出的热量为。
(3)碳的燃烧热△H= 。
(4) 在25℃、101kPa下, 1g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧热的热化学方程式。
(4分)(1)量取5mL浓硫酸的仪器是 ;量取20.00mL稀硫酸的仪器是 。
(2)在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH≒CH3COO-+H+ΔH > 0
下列方法中,可以使0.10 mol·L-1 CH3COOH溶液中CH3COOH电离程度增大的是。
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(10分).已知有以下物质相互转化
试回答:(1)写出B的化学式,D的化学式,
(2)写出由E转变成F的化学方程式。
(3)用KSCN鉴别G溶液的阳离子实验现象是。
向G溶液加入A的有关离子反应方程式