(1)无机化合物可根据其组成和性质进行分类。以下是一组对“一些物质与水反应”的分类图,请按要求填空:
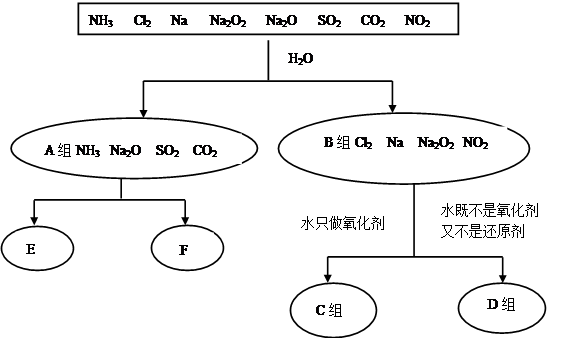
①上述分类中,分成A、B两组的依据是 ;
②C组物质与水反应的离子方程式为 ;
③D组物质与水反应中,氧化剂和还原剂物质的量之比为1∶1的物质有 (填化学式)。
(2)过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。关于双氧水,回答下列问题:
A.Na2O2+2HCl===2NaCl+H2O2
B.Ag2O+H2O2===2Ag+O2↑+H2O
C.2H2O2===2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
①上述反应中,H2O2既体现氧化性又体现还原性的反应是_____________;
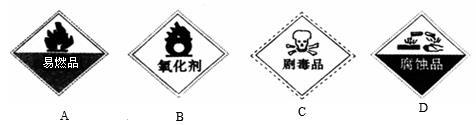
②保存过氧化氢的试剂瓶上最适合贴上的一个标签是_____________(填序号);
③H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称,如消除采矿业胶液中的氰化物(如KCN)。H2O2被称为绿色氧化剂的理由是________________。
(3)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
____CuO+____NH4Cl ____Cu+____CuCl2+____N2↑+____H2O
____Cu+____CuCl2+____N2↑+____H2O
①配平此氧化还原反应方程式;
②此反应中若产生0.2mol的气体,则有________mol的电子转移。
从石油裂解中得到的1,3—丁二烯可进行以下多步反应,得到重要的合成橡胶和杀菌剂富马酸二甲酯。
(1)写出D的结构简式 。
(2)写出A的结构简式 。
(3)写出第⑦步反应的化学方程式 。
(4)写出富马酸的一种相邻同系物的结构简式 。
(5)写出第⑨步反应的化学方程式 。
(6)以上反应中属于消去反应的是 。(填入编号)
乳酸(CH3—CHOH—COOH)是人体生理活动的一种代谢产物,其聚合物(聚乳酸)是一种新型可生物降解的高分子材料,主要用于制造可降解纤维、可降解塑料和医用材料。下图是工业上用化学方法对乳酸进行加工处理的过程,其中A、H、G为链状高分子化合物。
物质H的结构简式为 ,回答下列问题:
,回答下列问题:
(1)写出下列物质的结构简式:C,F。
(2)上述反应①~⑦中,②是反应,⑥是反应。(填反应类型)
(3)写出下列反应的化学方程式:
①。
⑦。
(4)隐形眼镜的制作材料,应具有良好的光学性能、良好的透气性能和亲水性。一般采用G来制作隐形眼镜而不用H,其主要理由是。
某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol· L-1盐酸、0.55mol· L-1NaOH溶液,
尚缺少的实验玻璃用品是、。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?
(填“能”或“否”),其原因是。
(3)他们记录的实验数据如下:
| 实 验 用 品 |
溶 液 温 度 |
中和热 △H |
|||
| t1 |
t2 |
||||
| ① |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.3℃ |
|
| ② |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.5℃ |
已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均为1g·cm-3。计算完成上表。
(4)实验中NaOH的浓度比HCl的大,其原因是
(5)若用KOH代替NaOH,对测定结果(填“有”或“无”)影响;若用醋酸代替HCl做实验,则测定结果(填“偏高”“偏低”或“无影响”)。
甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ/mol;
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g)ΔH2=-192.9 kJ/mol。
(1)甲醇蒸气完全燃烧的热化学反应方程式为__________________________。
(2)反应②中的能量变化如图所示,则ΔH2=________ kJ/mol(用E1、E2表示)。
(3)H2(g)的燃烧热为________。
(4)请你分析H2(g)作为能源比甲醇蒸气作为能源的优点:______(写出两点即可)。
某学生取9g淀粉溶于水,为测定淀粉的水解百分率,其程序如图: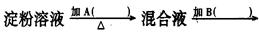

(1)各步所加试剂为:
A、B、C、D。
(2)实验中必须加B溶液的理由是。
(3)当析出2.16g沉淀时,淀粉水解率为。