氧元素与多种元素具有亲和力,所形成化合物的种类很多。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为________。氧元素与氟元素能形成OF2分子,该分子的空间构型为________。
(2)根据等电子原理,在NO2+离子中氮原子轨道杂化类型是________;1 mol O22+中含有的π键数目为________个。
(3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。Cr3+基态核外电子排布式为________。
(4)钙在氧气中燃烧时得到一种钙的氧化物晶体,其晶体结构如图所示,则该钙的氧化物的化学式为________。
(5)下列物质的分子与O3分子的结构最相似的是________。
| A.H2O | B.CO2 | C.SO2 | D.BeCl2 |
(6)O3分子是否为极性分子?________。
下图中,B、D、E、F、G是氧化物,F、K是氢化物,C、H是日常生活中常见的金属单质,J是黄绿色气态单质,M与氨水反应生成的O是白色沉淀。在B、H、L、M、N、O中含有同种元素,I是基础化学工业的重要产品(图中部分反应物和生成物没有列出)。
请按要求回答:
(1)H元素在周期表中的位置。
(2)反应③的离子方程式;
反应④的化学方程式 。
(3)实验室用固体L配制溶液的方法是:
。
(4)由L的饱和溶液可以制得胶体,胶体中粒子直径的大小范围是。若要提纯该胶体,采用的方法叫。
(1)某课外活动小组同学用图 1装置进行实验,试回答下列问题。
1装置进行实验,试回答下列问题。
①若开始时开关K与a连接,则铁发生电化学腐蚀中的腐蚀;
②若开始时开关K与b连接,则总反应的离子方程式。
图1图2
(2)芒硝化学式Na2SO4·10H2O,无色晶体,易溶于水,是一 种分布很广泛的硫酸盐矿物。该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图2所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是提高原料的利用率而言都更加符合绿色化学理念。
种分布很广泛的硫酸盐矿物。该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图2所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是提高原料的利用率而言都更加符合绿色化学理念。
①该电解槽的阳极反应式为。此时通过阴离子交换膜的离子数(填“大于”或“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钠溶液从出口(选填“A”、“B”、“C”、“D”)导出。
③若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池负极的电极反应式为。已知H2的燃烧热为285.8 kJ/mol,则该燃料电池工作产生36 g H2O时,理论上有kJ的能量转化为电能。
有甲、乙两个容积均为1 L的密闭容器,在控制两容器的温度相同且恒定的情况下进行反应:2A(g)+B(g) 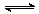 xC(g),①向甲中通入4 mol A、2 mol
xC(g),①向甲中通入4 mol A、2 mol  B,达平衡时测得其中C的体积分数为40%;②向乙中通入1 mol A、0.5 mol B和3 mol C,平衡时测得C的体积分数为W%。试回答:
B,达平衡时测得其中C的体积分数为40%;②向乙中通入1 mol A、0.5 mol B和3 mol C,平衡时测得C的体积分数为W%。试回答:
(1)若乙W%=40%,且建立平衡的过程中乙压强有变化,则x=。
(2)若乙W%=40%,且平衡时甲、乙压强不同,则乙平衡时c(A) =。
(3)若x=4,则W%40% (填“大于”、“小于”或“等于”)。
实验室制取氯气方法很多,通常有如下三种:
(1)用二氧化锰与浓盐酸共热制取氯气。如果将过量二氧化锰与20 mL 12 mol/L的浓盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。产生该结果的主要原因是:①,②。
(2)高锰酸钾与浓盐酸反应可制取氯气,其反应的化学方程式为:
。
若消耗0.1 mol氧化剂,则被氧化的还原剂的物质的量为mol。
(3)现按如下操作进行有关氯气的制备及性质实验:在一片下衬白纸的圆形玻璃片上(如下图),A点滴一滴0.1 mol/L KI溶液(含淀粉溶液),B点滴一滴FeSO4(含KSCN)溶液,C点滴一滴NaOH(含酚酞)溶液,O点放少量KClO3晶体。向KClO3晶体滴加一滴浓盐酸,立即用表面皿盖好。试回答下列问题: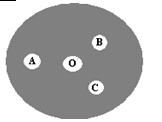
①A点反应的离子方程式为;
②B点的现象为;
③C点的溶液由红色变为无色,是因为中和褪色还是漂白而褪色,请你设计实验证明之。。
如下图所示,从A出发可发生一系列化学反应,其中化合物B以铁做催化剂进行溴代时,一溴代物只有两种,F遇氯化铁溶液不变色,G为高分子化合物。
已知: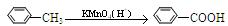
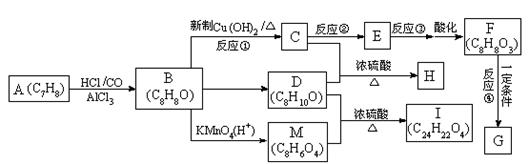
请根据上述信息填空:
(1)写出反应类型:反应①_____________________,反应④______________________。
(2)若反应③的条件为氢氧化钠溶液、加热,则反应②的条件可能为________(选填答案编号)。
| A.溴水、光照 | B.液溴、铁粉 |
| C.氢溴酸、加热 | D.氯气、光照 |
(3)H的结构简式为_______________________________________________。
(4)与C互为同分异构体且均属于酯类的芳香族的化合物共有_____种,其中苯环上的一取代物有四种的物质的结构简式为_____________________________________。
(5)写出下列反应的化学方程式:
F→G:________________________________________________________________;
D + M →I:____________________________________________________________。