(6分)开发新型储氢材料是氢能利用的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有______个。
②LiBH4由Li+和BH4-构成,BH4-呈正四面体构型。LiBH4中不存在的作用力有______(填标号)。
A.离子键 B.共价键 C.金属键 D.配位键
③Li、B、H元素的电负性由大到小排列顺序为______。
(2) 金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+______H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
M是______(填元素符号)。
(3)某种新型储氧材料的理论结构模型如下图所示,图中虚线框内碳原子的杂化轨道类型有______种。
按要求写出: 的结构简式_________;
的结构简式_________;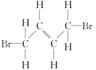 的键线式______;
的键线式______;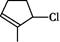 的分子式___________。
的分子式___________。
目前世界上比较先进的电解制碱技术是离子交换膜法。
(1)电解前,如果粗盐中SO42ˉ含量较高,必须添加试剂除去SO42ˉ,则按添加试剂顺序,依次发生反应的离子方程式为。
(2)补齐下列电解饱和食盐水制烧碱的离子方程式:
______________________  __________________________________
__________________________________
(反应物)(阴极产物)(阳极产物)
(3)在电解制得的NaOH中往往还含有一定量的NaCl,因此必需进行脱盐工序,脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过、冷却、(填写操作名称)除去NaCl。
(4)已知NaCl在60℃的溶解度为37.1 g,现电解60℃精制饱和食盐水1371 g。经分析,电解后溶液密度为1.37 g·cm-3,其中含有20gNaCl,则电解后NaOH的物质的量浓度为__________mo1·L-1(保留小数点后1位)。
化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌。同时,由于粗锌中还含有铁等杂质,使得溶液中混有一定量的硫酸亚铁,为了充分利用制氢废液,常用其制备皓矾(ZnSO4·7H2O)。某校化学兴趣小组的同学以制氢气的废液为原料来制取皓矾。制备皓矾的实验流程如下图所示。
已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:Fe(OH)3:2.7-3.7 Fe(OH)2:7.6-9.6 Zn(OH)2:5.7-8.0试回答下列问题:
(1)加入的试剂①,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,最好选用,其理由是;
(2)加入的试剂②,供选择使用的有:a、Zn粉,b、ZnO,c、Zn(OH)2,d、ZnCO3,e、ZnSO4等,可选用;
(3)从晶体1→晶体2,该过程的名称是;
(4)在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是。
磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等。
(1)磷的某种核素中,中子数比质子数多1,则表示该核素的原子符号为____________。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10 10C+P4O10=P4↑+10CO↑
上述反应中的各种物质,属于酸性氧化物的有。
(3)白磷有剧毒,不慎沾到皮肤上,可用CuSO4溶液冲洗解毒。白磷可与热的CuSO4溶液反应生成磷化亚铜,与冷溶液则析出铜,反应方程式分别(均未配平)为:
① P4+CuSO4+H2O→Cu3P+H3PO4+H2SO4
② P4+CuSO4+H2O→Cu+H3PO4+H2SO4
反应①中,氧化剂为,若上述两反应中被氧化的P4的物质的量相等,则消耗的CuSO4的物质的量之比为。
下表是元素周期表的一部分,A、B、C、D、E、X是下表中给出元素组成的常见单质或化合物。
已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)
(1)若E为单质气体,D为白色沉淀,A的化学式可能是, C与X反应的离子方程式为。
(2)若E为氧化物,则A与水反应的化学方程式为。
①当X是碱性盐溶液,C分子中有22个电子时,则C的结构式为,表示X呈碱性的离子方程式为。
②当X为金属单质时,X与B的稀溶液反应生成C的离子方程式为
。
(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,写出该可逆反应的化学方程式。t℃时,在密闭恒容的某容器中投入等物质的量的D和水蒸气,一段时间后达到平衡,该温度下反应的平衡常数K=1,D的转化率为。