用密度为1.84g/cm3,质量分数为98%的浓硫酸配制100mL 1.00mol/L 的稀硫酸。
(1)在容量瓶的使用方法中,下列操作不正确的是____________
| A.使用容量瓶前检验是否漏水 |
| B.容量瓶用水洗净后,再用待配溶液洗涤 |
| C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
| D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处, 用胶头滴管加蒸馏水至刻度线。 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(2) 经计算,上述浓硫酸的浓度为_______ mol/L。配制100mL1.00mol/L的稀硫酸,应用量筒量取浓硫酸的体积为_______mL(保留一位小数),量取时应选用_______ (填序号①10mL、②50mL 、③100mL)规格的量筒。
(3)请将下列步骤补充完整:
a. 量取所需浓硫酸在烧杯中加适量蒸馏水溶解,待溶液冷却到室温后将其沿玻璃棒移入 mL的容量瓶中,并将洗涤液移入容量瓶中。
b. 向容量瓶内加水,直到液面接近刻度线 cm时,改用 小心地加水至溶液凹液面与刻度线相切。
c. 将容量瓶盖好瓶盖,摇匀。
⑷配制过程中如果出现下列情况,会使溶液物质的量浓度如何变化?(填“偏高”、“偏低”或“不变”)
转移时未洗涤烧杯,则结果 ;
所用容量瓶未干燥,则结果 ;
定容时俯视,则结果 。
(10分)(1)某温度时,在2 L容器中,X、Y、Z三种物质的物质的量随时间变化曲线图所示。由图中数据分析,该反应的化学方程式为:______________________________________________________
反应开始至2 min,Z的平均反应速率为__________________。
(2)不同时间测得以下反应速率:①v(X)=0.075mol/(L·min)
②v(Y)=0.001mol/(L·s)③v(Z)=0.06mol/(L·min)
速率由大到小关系正确为:(填编号)
(3)可逆反应:
aA(g)+bB(g)  cC(g)+dD(g)的v-t图像如图所示:
cC(g)+dD(g)的v-t图像如图所示:
①其阴影面积表示的是________________________________
②若其他条件都不变,只是在反应前加入合适的催化剂,则阴影面积将________(填变大、不变或变小)
过渡金属在生产生活中的应用十分广泛。
Ⅰ.Cr元素形成的氯化铬酰(CrO2Cl2)有重要用途,在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
Ⅱ.Cu可形成多种配合物,根据下列信息回答问题:
(1)向盛有硫酸铜水溶液的试管里逐滴加入氨水,首先出现蓝色沉淀,继续滴加氨水,蓝色沉淀溶解,得到深蓝色的透明溶液,请写出先后发生的离子方程式
;
。
深蓝色溶液中配离子的立体构型为。
(2)再向深蓝色透明溶液加入乙醇,析出深蓝色的晶体。深蓝色晶体的化学式为。
(3)根据以上实验过程,判断NH3和H2O与Cu2+的配位能力:NH3H2O(填“>”、“=”或“<”);
Ⅲ.Ni(CO)6为正八面体结构,其中的镍原子位于正八面体的中心,配位体CO分子则在正八面体的六个顶点上。
(4)若把其中两个CO配位体换成 NH3 得到新的配合物,则以下物质中互为同分异构体的是。(填字母编号,任填一组。图中黑点为NH3,圆圈为CO,Ni略去)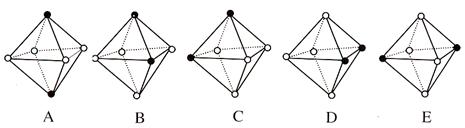
A、B、C、D、E五种短周期元素,原子序数依次增大,B与C能层数相同,D与E能层数相同,C与D价电子结构相同,基态时B、C、D原子核外皆有2个未成对电子,A、E只有1个未成对电子,A能分别与B、C、D、E形成不同的分子。
(1)写出基态时B的价电子排布图,E—的原子结构示意图。
(2)写出BCD的电子式,E2C的结构式。
(3)根据题目要求完成以下填空:
EC3—中心原子杂化方式;DC3中心原子杂化方式;
EC4—微粒中的键角;BC32—微粒的键角;
DE2分子的立体构型;B2A2分子的立体构型。
(4)一种由A、B、C三种元素组成的分子A2BC2,该分子中σ键数目为,π键数目为。
(5)根据等电子原理,指出与BC2互为等电子体的离子(一种即可)
(12分)根据已学知识,回答下列问题:
(1)具有(n-1)d10n s2电子构型的元素位于周期表中区和族。
(2)写出3P轨道上有2个未成对电子的元素名称:。
(3)日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素X,该元素的价电子排布式为3d54s1,该元素可与氧元素形成离子X2O72-,K2X2O7氧化浓盐酸生成氯气的同时还生成了X3+,写出该反应的离子方程式。
(4)键能是指气态基态原子形成1 mol化学键释放的最低能量。某些化学键的键能如下表
格所示(单位:kJ·mol-1):
| 键 |
H—H |
N N N |
O=O |
F—F |
H—Cl |
| 键能 |
436 |
946 |
498 |
157 |
431 |
| 键 |
N—N |
P—P |
P—O |
Cl—Cl |
Br—Br |
| 键能 |
193 |
198 |
360 |
242.7 |
193 |
①由表中所列化学键形成的单质分子中,最不稳定的是。
②通过表中键能数据,计算说明N2分子中的键比键稳定(填“ ”或“
”或“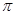 ”)。
”)。
③化学反应的实质是旧化学键断裂和新化学键形成的过程。现有化学反应方程式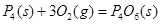 ,通过计算可以确定,1molP4(s)参加该反应,(填“吸收”或“放出”)的热量为kJ。
,通过计算可以确定,1molP4(s)参加该反应,(填“吸收”或“放出”)的热量为kJ。
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| A |
B |
C |
D |
||||||||||||||
| E |
F |
G |
H |
I |
|||||||||||||
| J |
K |
M |
|||||||||||||||
| L |
|||||||||||||||||
试回答下列问题:
(1)写出基态时J的电子排布式,L的原子序数为,M的简化电子排布式。
(2)下列关于元素在元素周期表中的位置的叙述正确的是。
A.K位于元素周期表中第四周期、ⅡB族,属于ds区元素;
B.J位于元素周期表中第四周期、ⅣB族,属于d区元素;
C.F位于元素周期表中第三周期、ⅡA族,属于s区元素;
D.I位于元素周期表中第三周期、ⅦA族,属于ds区元素;
(3)下列有关说法正确的是。
A.第一电离能G>F>E; B.电负性D>C;
C.原子半径E>B D.最高价含氧酸的酸性I>H
(4)根据对角线规则及已知元素性质,回答下列问题:
①B元素最高价氧化物的水化物与E元素最高价氧化物的水化物的溶液反应的离子方程
式。
②A元素的单质与氧气在点燃时的化学反应方程式。
(5)下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。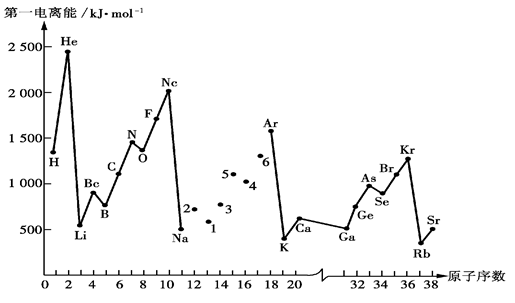
① 认真分析下图中同周期元素第一电离能的变化规律,将Na——Ar之间六种元素用短线连接起来,构成完整的图像。
② 从下图分析可知,同一主族元素原子的第一电离能I1变化规律是
___________________________________________________________________________;
Zn的第一电离能大于Ga的原因是
。
③上图中5号元素在周期表中的位置是____________________________;