A、B、C、D、E五种短周期元素,原子序数依次增大,B与C能层数相同,D与E能层数相同,C与D价电子结构相同,基态时B、C、D原子核外皆有2个未成对电子,A、E只有1个未成对电子,A能分别与B、C、D、E形成不同的分子。
(1)写出基态时B的价电子排布图 ,E—的原子结构示意图 。
(2)写出BCD的电子式 ,E2C的结构式 。
(3)根据题目要求完成以下填空:
EC3—中心原子杂化方式 ;DC3中心原子杂化方式 ;
EC4—微粒中的键角 ;BC32—微粒的键角 ;
DE2分子的立体构型 ;B2A2分子的立体构型 。
(4)一种由A、B、C三种元素组成的分子A2BC2,该分子中σ键数目为 ,π键数目为 。
(5)根据等电子原理,指出与BC2互为等电子体的离子 (一种即可)
下图是某研究性学习小组设计的对一种废旧合金的各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。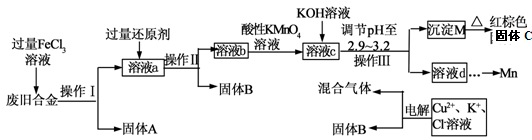
已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38, Ksp[Mn(OH)2] =1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是。
(2)加入过量FeCl3溶液过程中可能涉及的化学方程式:。
(3)过量的还原剂应是。
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为。
②若用X mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液YmL,则最后所得红棕色固体C的质量为g(用含X、Y的代数式表示)。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为:﹥﹥。(填金属阳离子)
(6)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为Z g,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为L(用含Z的代数式表示);该电极的反应式为 .
工业制硫酸的过程中利用反应2SO2(g)+O2(g) 2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
(1)一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1mol O2发生反应,则下列说法正确的是。
A.若反应速率v (SO2) ﹦v (SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,充入2 mol N2,化学反应速率加快
C.平衡后仅增大反应物浓度,则平衡一定右移,各反应物的转化率一定都增大
D.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
E.平衡后升高温度,平衡常数K增大
F.保持温度和容器体积不变,平衡后再充入2molSO3,再次平衡时各组分浓度均比原平衡时的浓度大
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| SO2 |
O2 |
SO2 |
O2 |
|||
| 1 |
T1 |
4 |
2 |
x |
0.8 |
6 |
| 2 |
T2 |
4 |
2 |
0.4 |
y |
9 |
①实验1从开始到反应达到化学平衡时,v(SO2)表示的反应速率为,表中y﹦。
②T1T2 ,(选填“>”、“<”或“="”)," 实验2中达平衡时 O2的转化率为。
(3)尾气SO2用NaOH溶液吸收后会生成Na2SO3。现有常温下0.1 mol/L Na2SO3溶液,实验测定其pH约为8,完成下列问题:
① 该溶液中c(Na+)与 c(OH-)之比为。
② 该溶液中c(OH-)= c(H+)+ + (用溶液中所含微粒的浓度表示)。
③ 当向该溶液中加入少量NaOH固体时,c(SO32-), 水的离子积Kw。(选填“增大”、“减小”或“不变”)
(4)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是 。
A. Na2CO3B. Ba(NO3)2 C.Na2S D.酸性KMnO4
分子式为C12H14O2的有机物H广泛用于制备香精的调香剂。为了合成该有机物,某实验室的科技人员设计了下列合成路线。
试回答下列问题:
(1)A的名称:;E的结构简式:
(2)反应④的反应类型为;
(3)反应②的化学方程式为;
反应⑥的化学方程式为;
(4)按要求写出G的同分异构体的结构简式。要求:①属于芳香族化合物。②遇浓溴水能产生白色沉淀。③苯环上的取代物只有两种。。
下表为长式周期表的一部分,其中的编号代表对应的元素。
(1)元素③基态原子的电子排布式为。
(2)②与⑦形成的化合物的空间构型为。
(3)元素②④⑤⑥的第一电离能由大到小的顺序是(填元素符号)
(4)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因。
(5)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构如图所示。下列说法正确的是
a.在上述结构示意图中,所有氧原子都采用sp3杂化
b.在上述结构示意图中,存在配位键、共价键和离子键
c.胆矾是分子晶体,分子间存在氢键
d.胆矾中的水在不同温度下会分步失去
(6)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是。
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。已知:NaClO2饱和溶液在温度低于38oC时析出的晶体是NaClO2·3H2O,高于38oC时析出晶体是NaClO2,高于60oC时NaClO2分解成NaClO3和NaCl。利用下图所示装置制备亚氯酸钠。装置②反应容器为三颈烧瓶。
完成下列填空:
(1)组装好仪器后,检查整套装置气密性的操作是:。
(2)装置②中产生ClO2的化学方程式为 。
装置④中发生反应的离子方程式为。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55oC蒸发结晶;②;③;④低于60oC干燥,得到成品。
(4)目前已开发出用电解法制取ClO2的新工艺。
①上图是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图。则阳极产生C1O2的电极反应为 。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为mol。
(5)准确称取所得亚氯酸钠样品l0 g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2-+4I-+4H+=2H2O+2I2+C1-)。将所得混合液配成250 mL待测溶液。配制待测液需用到的定量玻璃仪器是;取25.00 mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为。重复滴定2次,测得Na2S2O3溶液平均值为20.00 mL。该样品中NaClO2的质量分数为。