图1是产生和收集气体的实验装置,该装置适合于( )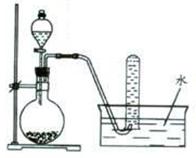
| A.用浓硝酸与Cu反应制取NO2 |
| B.用H2O2溶液和MnO2反应制取O2 |
| C.用浓盐酸和MnO2反应制取C12 |
| D.用NH4C1和Ca(OH)2反应制取NH3 |
将0.20 mol NO和0.1 mol CO充入一个容积恒定为1L的密闭容器中发生反应:2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0在不同条件下,反应过程中部分物质的浓度变化如图所示。
N2(g)+2CO2(g) △H<0在不同条件下,反应过程中部分物质的浓度变化如图所示。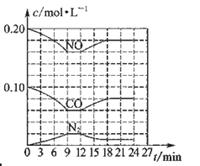
下列说法正确的是
| A.容器内的压强不发生变化说明该反应达到平衡 |
| B.当向容器中再充入0.20 mol NO时,平衡向正反应方向移动,K增大 |
| C.第12 min时改变的反应条件为减小压强 |
| D.向该容器内充入He气,容器内气体压强增大,所以反应速率增大 |
一定条件下存在反应:2SO2(g) +O2(g) 2SO3(g),ΔH<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
2SO3(g),ΔH<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是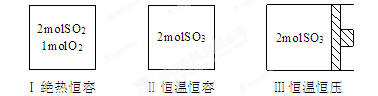
| A.容器I、Ⅲ中平衡常数相同 |
| B.容器II、Ⅲ中正反应速率始终相同 |
| C.容器Ⅱ、Ⅲ中的反应达平衡时,SO3的体积分数:II>III |
| D.容器I中SO2的转化率与容器Ⅱ中SO3的转化率之和等于1 |
关于25℃时,pH = 12的NaOH溶液,下列说法错误的是
| A.c(OH-) =c(Na+) + c(H+) |
| B.由水电离出的c(OH-) = 1.0×10-12 mol·L-1 |
| C.与等体积pH = 2的醋酸混合后所得溶液显碱性 |
| D.与等体积0.01 mol·L-1氯化铵溶液混合后所得溶液中:c(Na+)> c(NH4+) |
下列关于电解质溶液中离子数目的判断正确的是
| A.0.1L 3.0mol/L的NH4NO3溶液中含有的NH4+的数目为0.3NA |
| B.等体积、等物质的量浓度的NaCl和KCl溶液中,阴、阳离子数目之和均为2NA |
| C.0.1mol/L的NaHSO4溶液中,阳离子的数目之和为0.2NA |
| D.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.1NA |
处于平衡状态的反应2H2S(g) 2H2(g)+S2(g) ΔH>0,下列说法正确的是
2H2(g)+S2(g) ΔH>0,下列说法正确的是
| A.若体系恒容,通入H2S(g),则正反应速率增大,逆反应速率减小 |
| B.升高温度,正逆反应速率都增大,H2S分解率也增大 |
| C.增大压强,平衡向逆反应方向移动,将引起体系温度降低 |
| D.若体系恒容,注入一些H2后达新平衡,H2浓度将减小 |