碘在科研与生活中有重要应用。某兴趣小组用0.50mol·L-1KI、0.2%淀粉溶液、0.20mol·L-1K2S2O8、0.10mol·L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知: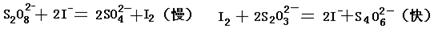
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表: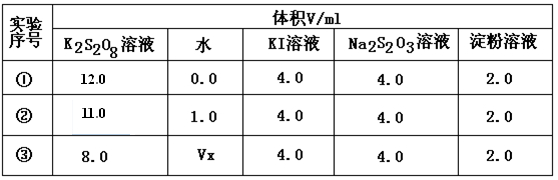
表中Vx= mL,理由是 。
已知某条件下,浓度c(S2O82—)~反应时间t的变化曲线如图,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82—)~t的变化曲线示意图(进行相应的标注)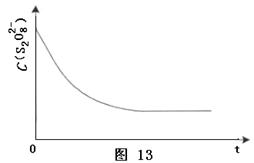
碘也可用作心脏起搏器电源—锂碘电池的材料。该电池反应为:
2Li(s)+I2(s)="2LiI" (s) △H
已知:4Li(s)+O2(g)=2Li2O(s) △H1
4 LiI(s)+O2(g)=2I2(s)+2Li2O(s) △H2
则电池反应的△H=_______________
在830K时,下列反应的平衡体系具有某些特殊性:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
①若起始浓度分别为c(CO)=3 mol·L-1,c(H2O)=0.75mol·L-1,达到平衡后CO的转化率为20%
②若起始浓度分别为c(CO)=3 mol·L-1,c(H2O)=4.5mol·L-1,达到平衡后CO的转化率为60%
设830K时,以起始浓度分别以c(CO)=a mol·L-1,c(H2O)=b mol·L-1投料,发生以上反应,测得平衡后c(H2)=c mol·L-1.
请注意上述数据,总结出其中规律,填写以下空白。
(1)选择填空:在多次试验中,若保持b不变而减小a,则达到平衡时CO的转化率________ 水蒸气的转化率________.
| A.增大 | B.减小 | C.不变 | D.无法确定 |
(2)当a=4,c=1.5时,b=______________.
(3)当a=2b时,a∶c=______________.
(4)a、b、c在该平衡中的关系式是__________________.
在密闭容器中,N2、H2起始的物质的量分别为10mol、30mol,达到平衡时N2的转化率为25%,若反应从NH3的分解开始,在相同条件下欲使平衡时各成分百分含量相同,则应加入氨的物质的量为__________,氨的转化率为__________。
在体积为VL的密闭容器中,充入a molN2和b molH2,经3分钟生成c molNH3。
(1)v(N2)应表示为_______________(2)H2的转化率为_______________
(3)NH3的体积分数为_____________(4)反应前后的压强比为____________
CuCl2溶液有时呈黄色,有时呈绿色或蓝色,这是因为CuCl2的水溶液中存在如下平衡: [CuCl2(H2O)4]2+ + 4Cl- [CuCl4]2- + 4H2O。
[CuCl4]2- + 4H2O。
蓝色 黄色
现欲使溶液由黄色变为绿色或蓝色,请写出两种可采用的方法。
通过实验测定反应速率的方法有多种,如比较锌粒与不同浓度硫酸反应时的速率,可通过测定收集等体积H2需要的____________来实现;在KMnO4与H2C2O4反应中,可通过测定____________________________来测定该反应的速率;在Na2S2O3和H2SO4反应中,该反应的速率可通过__________________________来测定。写出KMnO4与H2C2O4反应的离子方程式:。