(16分)一种由甲醇、氧气以及强碱做电解质溶液的新型手机电池,容量达氢镍电池或锂电池的10倍,可连续使用一个月才充一次电。请完成下列与甲醇有关的问题。
(1)工业上有一种生产甲醇的反应为: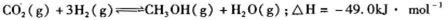
在温度和容积相同的A、B两个容器中,按不同方式投人反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
①从反应开始到达到平衡时,A中用CO2来表示的平均反应速率为__________________(用含C1的表达式表示)。
②a =_________。
(2)某同学设计了一个甲醇燃料电池,并用该电池电解200mL—定浓度NaCl与CuSO4混合溶液,其装置如图: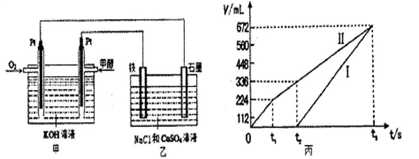
①写出甲中通入甲醇这一极的电极反应式__________________________________________
②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t2后,铁电极上的电极反应式_________________________;在t2时所得溶液的pH为______。(假设溶液体积不变)
(3)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如图l所示装置中,以稀土金属材料做惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y203的Zr02固体,它在高温下能传导O2-离子
①d电极的名称为 .
②如图2所示用铂电极电解足量CuS04溶液,b电极上的电极反应式为 .若电解一段时间后要使电解质溶液恢复到电解前的状态,可加入 (填序号).
a.CuO b.Cu(OH)2 c.CuC03 d.Cu2(OH)2C03
以下是日常生活中常见的一些物质:①液氧、②氢气、③水、④空气、⑤二氧化碳、
⑥氯酸钾、⑦水泥、⑧石油、⑨水银、⑩碱式碳酸铜、⑾纯净的矿泉水,请你指出(填序号):
(1)属于金属单质的是,属于非金属单质的是。
(2)属于化合物的是,含有元素种类最多的化合物是。
(3)属于混合物的是。
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题
已知:CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度变化如下表:
H2(g)+CO2(g)的平衡常数随温度变化如下表:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数Kc |
9.94 |
9 |
1 |
试回答下列问题
(1)上述逆反应是: 反应(选填:“放热”、“吸热”)。
(2)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有 (选填A、B、C、D、E)。
| A |
B |
C |
D |
E |
|
| n(CO2) |
3 |
1 |
0 |
1 |
1 |
| n(H2) |
2 |
1 |
0 |
1 |
2 |
| n(CO) |
1 |
2 |
3 |
0.5 |
3 |
| n(H2O) |
5 |
2 |
3 |
2 |
1 |
(3)已知在一定温度下:C(s)+CO2(g)  2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s) + H2O(g)  CO(g)+H2(g)平衡常数K1;
CO(g)+H2(g)平衡常数K1;
CO(g)+H2O(g) H2(g)+CO2(g) 平衡常数K2 。
H2(g)+CO2(g) 平衡常数K2 。
则K、K1、K2之间的关系是: 
(4)在VL密闭容器中通入10molCO和10mol水蒸气,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时各物质的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO燃烧热为283kJ/mol,H2燃烧热为286kJ/mol),则T℃平衡常数K= 。
降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应式为。
(2)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) 。
CH3OH(g)+H2O(g) 。
实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。
①图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应
是(填“吸热”或“放热”)反应。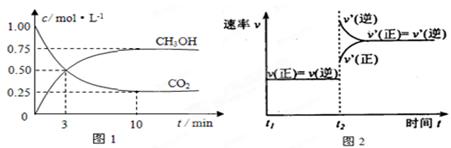
②500℃达平衡时,CH3OH的体积分数为。
(1)将反应2H2(g)+O2(g)=2H2O(1) △H<0,以KOH溶液为电解质溶液,设计一个原电池,其负极反应为:。
(2)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与下图中电解池相连,其中,a为电解液,X和Y是两块电极板,则: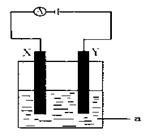
①若X和Y均为惰性电极,a为CuSO4溶液,则电解时的化学反应方程式为:。
通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为。
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为。
一定温度下,在一个10L密闭容器中只投反应物发生某可逆反应,其平衡常数表达式为K=  ,请回答下列问题:
,请回答下列问题:
(1)该反应的化学方程式为___________________________________;若温度升高,K增大,则该反应是____反应(填“吸热”或“放热”)。
(2)能判断该反应一定达到平衡状态的是__________(填字母序号)。
| A.υ正(H2O)=υ逆(H2) |
| B.容器中气体的平均相对分子质量不随时间改变 |
| C.消耗nmolH2的同时消耗nmolCO |
| D.容器中物质的总物质的量不随时间改变 |
(3)该反应的υ正随时间变化的关系如图,在t2时改变了某种条件,改变的条件可能是_________________________、________________________。