对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含氰废水中的CN-有剧毒。
①CN-中C元素显+2价, N元素显-3价,用原子结构解释N元素显负价的原因是 ,共用电子对偏向N原子,N元素显负价。
②在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为 。
(2)含乙酸钠和对氯酚(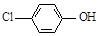 )的废水可以利用微生物电池除去,其原理如下图所示。
)的废水可以利用微生物电池除去,其原理如下图所示。
①B是电池的 极(填“正”或“负”);
②A极的电极反应式为 。
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A- 表示乳酸根离子)。
阳极的电极反应式为 。
简述浓缩室中得到浓乳酸的原理: 。
③ 电解过程中,采取一定的措施可控制阳极室的pH约为6-8,此时进入浓缩室的OH-可忽略不计。400mL 10 g•L-1乳酸溶液通电一段时间后,浓度上升为145 g•L-1(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为 L。(乳酸的摩尔质量为90 g• mol-1)
由铁矿石生产金属铁有两种可能的途径:
①Fe2O3(s)+3∕2C(s)="=2Fe(s)+" 3∕2CO2(g)
△H=231.93kJ·mol-1△S=276.32J·mol-1·K-1
②Fe2O3(s)+3H2(g)==2Fe(s)+3H2O(g)
△H=96.71kJ·mol-1△S=138.79J·mol-1·K-1
(1)试判断这两个反应在高温还是低温下自发进行。
(2)上述反应中的(填序号)可以在较低温度下进行。
已知反应N2O4(g)==2NO2(g)△H=57.24kJ·mol-1△S=176J·mol-1·K-1则在298.15K时该反应自发向进行(填“左”或“右”),在500K时反应自发向进行。
12分)判断下列过程的熵变的正负(填“>0”或“<0”)
(1) 溶解少量蔗糖于水中, △S__________;
(2) 纯碳和氧气反应生成 CO(g), △S__________;
(3) 液态水蒸发变成水蒸气, △S____________;
(4) CaCO3(s)加热分解生成CaO(s)和CO2(g),△S____________。
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。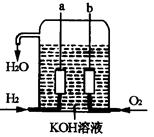
(1)a极是极,b极是极,电极
反应式分别为,。
(2)飞船上宇航员的生活用水由燃料电池提供。已知这种电池发1度电时能生成350g水,试计算能量转化率。 [2H2(g)+O2(g) 2H2O(l)+572kJ]
[2H2(g)+O2(g) 2H2O(l)+572kJ]
(3)这种电池的输出电压为1.2V。要使标有1.2V,1.5W的小灯泡连续发光0.5h,应消耗标准状况下的H2多少升?
(4)氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料,往往是某些碳氢化合物,如甲烷(天然气)、汽油等。请写出将图中H2换成CH4时所构成的甲烷燃料电池中a极的电极反应式:。此时电池内总的反应方程式为。
下列三个反应在某密闭容器中进行:
反应① Fe(s)+CO2(g) FeO(s)+CO(g)△H1=" a" kJ·mol-1
FeO(s)+CO(g)△H1=" a" kJ·mol-1
反应② 2CO(g)+O2(g) 2CO2(g)△H2=" b" kJ·mol-1
2CO2(g)△H2=" b" kJ·mol-1
反应③ 2Fe(s)+O2(g) 2FeO(s)△H3
2FeO(s)△H3
(1)则△H3=(用含a、b的代数式表示)
(2)已知500℃时反应①的平衡常数K=1.0,在此温度下2L密闭容器中进行反应①,Fe和CO2的起始量均为2.0mol,达到平衡时CO2的转化率为
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则
a0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其它条件不变时,可以采取的措施有(填序号)。
| A.缩小反应器体积 | B.再通入CO2 |
| C.升高温度 | D.使用合适的催化剂 |
(4)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为: 。则在电解法合成氨的过程中,应将H2不断地通入极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为。
。则在电解法合成氨的过程中,应将H2不断地通入极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为。
(5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显___________性(填“酸”“碱”或“中”), 可推断a 0.01(填大于、等于或小于)。