(12分)草酸与高锰酸钾在酸性条件下能够发生如下反应:
2MnO4- + 5H2C2O4 +6H+ =2Mn2+ +10CO2↑ +8H2O
用4mL0.001mol/LKMnO4溶液与2mL0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 |
10%硫酸溶液的体积/mL |
温度/℃ |
其他物质 |
| Ⅰ |
2mL |
20 |
无 |
| Ⅱ |
2mL |
20 |
10滴饱和MnSO4溶液 |
| Ⅲ |
2mL |
30 |
无 |
| Ⅳ |
1mL |
20 |
1mL蒸馏水 |
(1)如果研究催化剂对化学反应速率的影响,应使用实验 和 (用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,应使用实验 和 。
(2)对比实验Ⅰ和Ⅳ,可以研究 对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是 。
(3)在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度。在H2SO4溶液中,反应如下:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
①用托盘天平称取W g Na2C2O4晶体。
②将WgNa2C2O4配成100 mL标准溶液,量取20.00 mL置于锥形瓶中,
酸性KMnO4溶液应装在________(填“酸式”或“碱式”)滴定管中。
③若滴定管的起始读数和终点读数如图所示,则酸性KMnO4的物质的浓度为________ (填表达式,用W表示)。
利用“化学蒸气转移法”提纯金属钨的反应原理为:W(s)+I2(g) WI2(g) △H<0
WI2(g) △H<0
(1)该反应的平衡常数表达式K=_________。
(2)在恒温恒容条件下,能够说明上述反应一定达到平衡状态的是_________(填代号)。
a.I2(g)与WI2(g)的浓度相等
b.W的质量不再变化
c.容器内混合气体的密度保持不变
d.容器内混合气体的压强保持不变
(3)在一定温度下,若平衡常数K=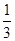 ,向2L恒容密闭容器中加入l mol I2(g)和足量W(s),5 min后反应达到平衡。则0-5 min内的平均反应速率v(WI2)=_________,平衡时I2(g)的转化率为_________。相同温度下,若开始加入I2(g)的物质的量是原来的2倍,则下列数值是原来的2倍的是____(填代号)。
,向2L恒容密闭容器中加入l mol I2(g)和足量W(s),5 min后反应达到平衡。则0-5 min内的平均反应速率v(WI2)=_________,平衡时I2(g)的转化率为_________。相同温度下,若开始加入I2(g)的物质的量是原来的2倍,则下列数值是原来的2倍的是____(填代号)。
a.平衡常数b.达到平衡的时间
c.I2的物质的量浓度d.平衡时WI2的体积分数
(4)为提高该反应的反应速率,同时使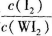 增大,可采取的措施为 ____________.
增大,可采取的措施为 ____________.
(5)工业上利用上述反应原理提纯金属钨的示意图如下: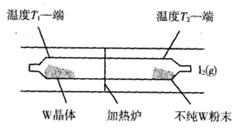
反应在石英真空管中进行,先在温度为T2的一端放入未提纯的W粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的晶体,则温度T1_________T2(填“>”‘<”或“=”)。上述反应体系中循环使用的物质是_________.
准确称取6g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mL 稀H2SO4溶液的烧杯中,充分反应后过滤去掉沉淀A,向滤液中加入10mol/L的KOH溶液,产生沉淀的质量和加入的KOH溶液的体积(mL)如右图所示。试回答下列问题: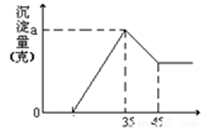
(1)沉淀A是(填化学式),当加入KOH溶液的体积超过35mL时所发生的反应的离子方程式为(4分)
(2)铝土矿中Al2O3的物质的量是多少?(2分)
(3)稀硫酸溶液的物质的量浓度为多少?(忽略溶液体积的变化)(2分)
如图所示:丁可能是强酸也可能是强碱。
(1)若丙是潜艇的供氧剂,请写出甲与水反应的离子方程式;若等物质的量的甲,乙,丙,丁的固体投入到足量且等量的水中完全反应所得溶液的质量分数由大到小的顺序是(用化学式表示)。
(2)若乙是能使品红溶液褪色的气体,请写出乙→丙的化学反应方程式;请写出乙可使氯水褪色的离子方程式__________________________.
(3)若甲可作为制冷剂,请写出甲→乙的化学反应方程式;将等量的铜粉分别与过量浓的丁溶液、稀的丁溶液反应,消耗丁的物质的量:前者后者,反应中转移的电子总数:前者后者(填“>”、“=”或“<”)
某学生课外活动小组利用下图所示装置分别做如下实验:
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是溶液;加热时溶液由红色逐渐变浅的原因是。(用化学反应方程式表示)
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是溶液;加热时溶液由无色变为红色的原因。
(本题共2小题,共10分)
(1)相同温度下等物质量浓度的下列溶液中,
| A.NH4Cl | B.NH4HCO3 | C.NH4HSO4 | D.(NH4)2SO4 |
①pH值由大到小的顺序是(用对应的字母填写)。
②NH4+离子浓度由大到小的顺序是(用对应的字母填写)。
③若上述溶液的pH值相同,则其物质的量浓度关系是(用对应的字母填写)。
(2)向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=________。
②完全沉淀后,溶液的pH=________。