铁是人类较早使用的金属之一。运用铁及其化合物的有关知识,同答下列问题:
(1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是________。(填序号)
a.纯铁硬度比生铁高
b.纯铁耐腐蚀性强,不易生锈
c.不锈钢是铁合金,只含金属元素
d.铁在一定条件下,可与水蒸气反应
e.铁在冷的浓硫酸中钝化
(2)向沸水中逐滴滴加1mol L-1FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为_____________ ,所形成该分散系的微粒范围是__________。
L-1FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为_____________ ,所形成该分散系的微粒范围是__________。
(3)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路极。请写出FeCl3溶液与铜反应的离子方程式___________ 。
(4)高铁酸钠(Na2FeO4)是一种新型净水剂。
①高铁酸钠在水中可以发生如下反应:4FeO4 +10H2O=4Fe(OH)3+8OH
+10H2O=4Fe(OH)3+8OH +3O2。由此看来,高铁酸钠能够杀菌消毒是因为它具有____________性,而能够除去水中悬浮物是因为__________。
+3O2。由此看来,高铁酸钠能够杀菌消毒是因为它具有____________性,而能够除去水中悬浮物是因为__________。
②下列物质能用作净水剂的有___________。
a.KAl(SO4)2 l2H2O b.聚合硫酸铁
l2H2O b.聚合硫酸铁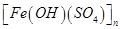
c.ClO2 d.“84”消毒液
已知I2+H2S====2HI+S。把Cl2缓慢通入到一含有I-、Br-、S2-(三者浓度相同)的溶液中,首先析出的是_________,最后析出的是_________。
(2)取2 g铝粉和3 g碘小心混匀,均分为四份。分别加0.5 g水,1 g胆矾,1 g无水硫酸铜,1 g明矾。加水的一份首先冒火花,发生剧烈反应,其次是加明矾的一份,而加无水硫酸铜的难发生反应。
①铝和碘发生反应的化学方程式为___________________________。
②铝和碘反应看到的现象是____________________________________。
③四份混合物发生反应的先后顺序说明:
a. ______________________________________________________,
b. ______________________________________________________。
向含有等物质的量的NaCl和NaBr的混合溶液中通入足量的氯气,反应完全后,将溶液蒸发至干,可得固体物质58.5 g,则原混合溶液中含Na+_______mol,含NaBr________g。
A、B、C、D、E五个集气瓶中分别充满了Cl2、O2、H2、HCl、HBr五种气体中的一种。A瓶中的气体是黄绿色;D和A中的气体混合见光会爆炸;B和A中的气体混合后在瓶壁上出现橙红色液滴;将E瓶的瓶盖打开,在潮湿空气中会出现白雾。根据以上现象判断各瓶的气体分别是A._______________________,B.____________________________,C. _______________________,D. _______________________,E. _______________________。
在很长的一个历史时期,人们一直认为氟的含氧酸不存在。1971年,美国科学家用F2通过细冰末获得了次氟酸(HFO),对次氟酸的研究引起了各国科学家充分的重视。
(1)次氟酸中氧元素的化合价是( )
A.0价 B.-1价 C.-2价 D.+2价
(2)次氟酸能与水反应得到溶液A,A中含有B、C两种溶质,其中B可用于雕刻玻璃。则次氟酸与水反应的化学方程式为________________________。
食用加碘盐可补充人体对碘的需要。有人偶尔把两种不同厂家生产的含碘食盐混合,发现混合物颜色逐渐变深,并会逸出少量紫色气体。这两种含碘食盐里碘形态可能分别是_________、___________。这两种含碘食盐在空气中暴露即可加以区别,这是因为其中一种含碘钾盐在空气中久置,特别是在阳光作用下会被氧气氧化而呈现碘单质的颜色。试写出该反应的化学方程式__________________________________。