(I)某学生设计了如图所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+H2SO4==H2↑+CuSO4,试回答:
(1)该装置的名称是 (填“电解池”或“原电池”)。
(2)A、B中至少有一种是金属 (填名称),接电源的 (填“正极”或“负极”)。
(3)写出该装置中发生还原反应的电极反应方程式为 。
(4)若C溶液为100ml饱和食盐水,A 和B电极均为碳棒,该学生利用图示装置进行电解,写出该电解过程中的总反应的离子方程式 ,当放出标况下112ml氢气时,该溶液的PH= (室温下)。
(II)利用下图装置,可以模拟铁的电化学防护。若X为铜,为减缓铁的腐蚀,开关K应置于________处。若X为锌棒,开关K置于M处,该电化学防护法称为 。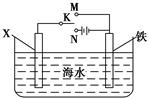
(10分) 根据下列合成流程图推断: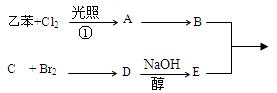
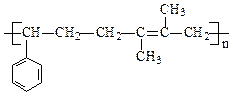
(1)写出下列物质结构简式:
B:C:E:
(2)判断①反应类型:。
(3)写出D→E的反应方程式:。
(11分) 肉桂酸甲酯是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。它的分子式为C10H10O2,且分子中只含有1个苯环,苯环上只有一个取代基。已知某一种肉桂酸甲酯的分子结构模型如下图所示(图中球与球之间连线表示单键或双键)。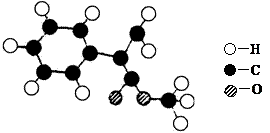
试回答下列问题。
(1)肉桂酸甲酯的结构简式为。
(2)分子中的官能团的名称为_____________________________________。
(3)在苯环上的一氯代物有____________种。
(4)写出该肉桂酸甲酯在氢氧化钠溶液中彻底水解的化学方程式:
______________________________________________________________________。
(11分) 用化学用语按要求填空:
(1)用系统命名法对下列有机物进行命名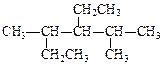 _________________________________
_________________________________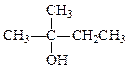 _________________________________
_________________________________
(2)试写出HCHO与足量银氨溶液反应的化学方程式
____________________________________________________________________
(3)TNT的结构简式_________________________________
(4)写出 的结构简式________________________________
的结构简式________________________________
A、B两种固体,都由甲、乙两种元素组成。在A、B中,甲(金属元素)、乙(非金属元素)两种元素的原子个数比分别为1:1和1:2。高温煅烧A、B时,产物都是C(固体)和D(气体)。由D可制得E(酸),E和另一种酸组成的混合酸跟甲苯反应可生成三硝基甲苯。C与E的稀溶液反应得到溶液F,往F溶液中加入NaOH溶液,有红褐色沉淀生成,该沉淀经灼烧后转变成C。往F溶液中加入甲元素的单质得到溶液G。试根据以上信息填写下列空白:
(1)A的化学式是
(2)B煅烧生成C和D的化学方程式是
(3)甲元素的单质与F溶液反应的离子方程式是
(4)往G溶液中加入NaOH溶液发生的现象是,
写出该反应的化学方程式、。
(5)工业上用D制E时,在原料气相同的情况下,测得压强对D平衡转化率的影响见下表:根据表中数据,考虑综合经济效益,你认为该反应应在下列哪中压强下进行最为有利:。
| 0.1MPa |
0.5MPa[ |
1 MPa |
10 MPa |
|
| 400℃ |
99.2% |
99.6%[ |
99.7% |
99.9%[来 |
| 500℃ |
93.5% |
96.9% |
97.8% |
99.3% |
| 600℃ |
73.7% |
85.8% |
89.5% |
96.4% |

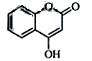
 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成: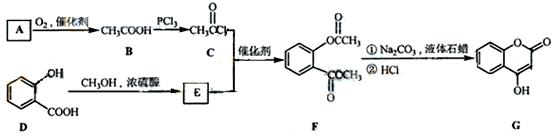


 (1)A与银氨溶液反应有银镜生成,则A的结构简式是。
(1)A与银氨溶液反应有银镜生成,则A的结构简式是。 (2)B→C的反应类型是。
(2)B→C的反应类型是。 (3)E的结构简式是
(3)E的结构简式是 (4)写出F和过量NaOH溶液共热时反应的化学方程式:
(4)写出F和过量NaOH溶液共热时反应的化学方程式:
 (5)下列关于G的说法正确的是
(5)下列关于G的说法正确的是 a.能与溴单质反应 b. 能与金属钠反应
a.能与溴单质反应 b. 能与金属钠反应 c. 1molG最多能和3mol氢气反应 d. 分子式是C9H6O3
c. 1molG最多能和3mol氢气反应 d. 分子式是C9H6O3