如下图是甲同学设计的证明CO具有还原性的实验装置。回答下列问题: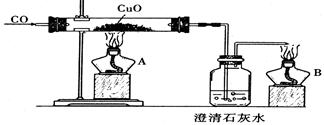
(1)硬质玻璃管中发生反应的化学方程式为 。
(2)广口瓶中的现象为 。
(3)酒精灯B的作用 。
(4)乙同学质疑CO能否使澄清石灰水变浑浊,因此其设计在CO通入CuO之前应先通入澄清石灰水以排除CO与澄清石灰水反应,试对此作出评价。你认为乙的设计(填“必要"或“不必要”) ,理由是 。
(5)丙同学认为甲设计的装置中尾气处理还可以用其他方法,请你为丙同学设计一种合理的尾气处理方法: 。
资料显示:“氨气可在纯氧中安静燃烧……”。某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。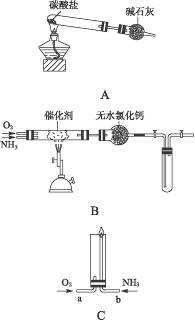
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是______________;碱石灰的作用是_______________________________________________________________________。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热;氨催化氧化的化学方程式是__________________________________________________________;试管内气体变为红棕色,该反应的化学方程式是____________________________________。
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气;
①两气体通入的先后顺序是______________,理由是_________________________________。
②氨气燃烧的化学方程式是_______________________________________________________。
如下图是课外活动小组同学设计的几种尾气吸收装置。从实验安全和保护环境的角度考虑,当用于吸收HCl气体时(装置中液体为水,固体为碱石灰),应选用的装置是______________(选填装置序号)。若用于吸收NH3,在上述已选用的装置中不宜采用的是______________,原因是____________________________________________;若用于吸收Cl2制取氯水,应选用的装置是_______________。
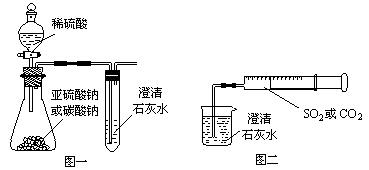
(13分)某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有能看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生现象明显比通入CO2快。
(1) 若锥形瓶内装的是亚硫酸钠,写出锥形瓶内反应的化学方程式:
_______________________________________________________________。
(2)对比分析两组实验,你认为用图一装置实验时,通入SO2不能出现浑浊的原因可能是:__________________________________________________________。写出此时试管内反应的化学方程式:______________________________________________________。
(3)用图二装置实验时,以相同速率通入CO2或SO2,SO2产生浑浊、澄清的现象比CO2快的原因是_______________________________________________________________。
(4)用图一进行SO2与石灰水反应的实验时,为防止SO2污染空气,应用盛有过量浓烧碱溶液的容器吸收SO2,写出容器内发生反应的化学方程式:
________________________________________________________________。
(本小题15分)为测定空气中CO2含量,做下述实验。
| 配0.1mol/L的标准盐酸和0.01mol/L的标准盐酸 |
→ |
用0.1mol/L的标准盐酸滴定未知Ba(OH)2溶液10mL用去盐酸19.60 mL |
→ |
用Ba(OH)2溶液吸收空气中的CO2 |
→ |
过 滤 |
→ |
取滤液20mL,用0.01mol/L的盐酸滴定用去盐酸34.8mL |
(1)为配置标准溶液,请选取必需的一组仪器。
①托盘天平 ②容量瓶 ③滴定管 ④量筒 ⑤烧杯 ⑥胶头滴管 ⑦玻璃棒
| A.①②⑤⑥ | B.②④⑤⑥⑦ | C.②①⑥⑦ | D.②④⑤⑥ |
(2)滴定操作时,左手,眼睛注视。
(3)取上述Ba(OH)2溶液10mL放入100mL容量瓶中,加水稀释至刻度,把稀释后的溶液放入密闭容器,并引入10L空气,振荡,过滤。需过滤的原因是。
(4)由实验数据算出空气中CO2的体积分数为。
(5)本实验中,若第一次滴定时使用的酸式滴定管未经处理,即更换溶液,进行第二次滴定,导致实验数据值(填偏高、偏低或无影响)。
(15分)海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下图: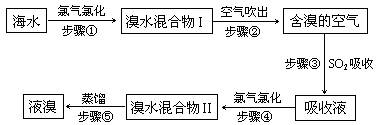
(1)步骤①反应的离子方程式是。
(2)步骤③反应的化学方程式是。
(3)Br的原子序数是,在周期表中位于周期族。
(4)步骤⑤蒸馏的过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因:。
(5)为什么不直接用“溴水混合物I”而要用“溴水混合物II”进行蒸馏,得到液溴?
。