滴定实验是化学学科中重要的定量实验。请回答下列问题:
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液。
①下列操作会造成测定结果偏高的是 (填选项字母)。
A、滴定终点读数时,俯视滴定管刻度,其他操作正确
B、盛NaOH溶液锥形瓶用蒸馏水洗后,未用NaOH溶液润洗
C、酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D、滴定前,滴定管尖嘴有气泡,滴定后气泡消失
②某学生的实验操作如下:
A、用碱式滴定管取稀NaOH溶液25.00 mL,注入锥形瓶中,加入甲基橙作指示剂
B、用待测定的溶液润洗碱式滴定管
C、用蒸馏水洗干净滴定管
D、取下酸式滴定管,用标准HCl溶液润洗后,注入标准液至“0”刻度以上2~3cm处,再把滴定管固定好,调节液面至“0”刻度或“0”刻度以下
E、检查滴定管是否漏水
F、另取锥形瓶,再重复操作一次
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
a.滴定操作的正确顺序是(用序号填写) 。
b.在G操作中如何确定终点? 。
(2)氧化还原滴定——取草酸溶液于锥形瓶中,加适量稀硫酸,用浓度为0.1 mol·L-1的高锰酸钾溶液滴定,发生反应为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+22MnSO4+8H2O。表格记录了实验数据:
| 滴定次数 |
待测液体积(mL) |
标准KMnO4溶液体积(mL) |
|
| 滴定前读数 |
滴定后读数 |
||
| 第一次 |
25.00 |
0.50 |
20.40 |
| 第二次 |
25.00 |
3.00 |
23.00 |
| 第三次 |
25.00 |
4.00 |
24.10 |
①滴定时,KMnO4溶液应装在 (“酸”或“碱”)式滴定管中,达终点时的现象是 。
②该草酸溶液的物质的量浓度为 。
(3)沉淀滴定——滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。
参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选的指示剂是 (填选项字母)。
| 难溶物 |
AgCl |
AgBr |
AgCN |
Ag2CrO4 |
AgSCN |
| 颜色 |
白 |
浅黄 |
白 |
砖红 |
白 |
| KSP |
1.77×10-10 |
5.35×10-13 |
1.21×10-16 |
1.12×10-12 |
1.0×10-12 |
A、NaCl B、NaBr C、NaCN D、Na2CrO4
Ⅰ.实验室经常要制取某种气体并验证该气体的性质。
(1)下列装置不适合用作尾气吸收的是(填序号)。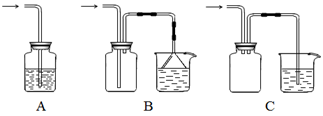
(2)向下列装置中通入气体X,A中品红溶液褪色,则X可能是SO2、Cl2等等。如果要证明X 是SO2气体,接下来的操作是:________________________________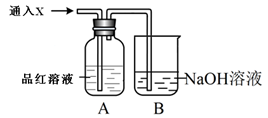
Ⅱ.实验室用FeSO4溶液和NaOH溶液反应制取Fe(OH)2,却很难看到稳定的白色沉淀。有同学设计了一种新的实验方法,能清楚看到生成白色沉淀及白色沉淀转化成红褐色沉淀的现象。请完成以下空白:
(1)取一定体积的0.1mol.L-1NaOH溶液放于烧杯中,加热煮沸后,再滴入几滴植物油;
(2)选择装置________(填“甲”或“乙”),将(1)所得溶液加入到装置中并按图示组装好装置。在你选择的装置上标明电极材料B为____________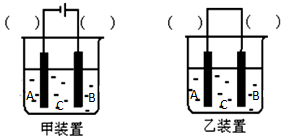
(3)实验中可在某电极处附近看到稳定的白色Fe(OH)2沉淀。若把NaOH溶液换成NaCl溶液,一段时间后则最先在处附近(填A、B或C)看到稳定的白色沉淀。为了尽快看到稳定的白色沉淀,可以采取的措施是(只写一种即可)
(4)如果要看到白色沉淀转化为红褐色沉淀的的现象,接下来的操作可以是__________
(本题共12分)下图是实验室制备1,2—二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略)。
有关数据列表如下:
请完成下列填空:
36.A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学反应方程式:__________________。
37.气体发生装置使用连通滴液漏斗的原因_________________________________________。
38.请写出C装置中的离子反应方程式_______________________________________。
39.装置D中品红溶液的作用是__________________________________;
40.反应过程中应用冷水冷却装置E,其主要目的是___________________________;但又不能过度冷却(如用冰水),其原因是___________________________________________。
41.学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是___________________。
42.有学生提出,装置F中可改用足量的四氯化碳液体吸收多余的气体,判断改用四氯化碳液体是否可行______(填“是”或“否”),其原因是__________________________。
(10+2分)某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体的是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。利用下图所示装置进行实验。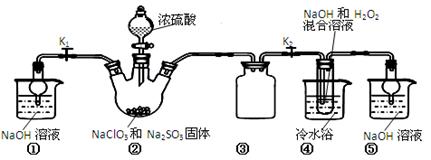
(1)装置①的作用是装置③的作用是。
(2)装置②中产生ClO2气体的化学方程式为。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55℃蒸发结晶;
②趁热过滤;
③;
④低于60℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用c mol•L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
样品中NaClO2的质量分数为(用含m、c、V的代数式表示)。
某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质等实验(图中夹持装置有省略)。请按要求填空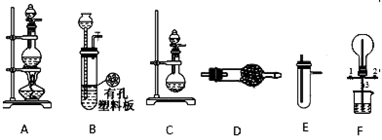
I.探究Cl2与 NH3的反应
(1)为制取干燥NH3,可将装置C与D装置连接;则装置C中的烧瓶内固体可以选用;(可多选)
A.碱石灰 B.无水CaCl2 C.P2O5 D.生石灰
(2)装置A、E、E(用两个相同的装置)连接可制取纯净、干燥的Cl2,则第一个E装置内的药品是;
(3)装置F可用于探究Cl2与 NH3(已知Cl2与 NH3可发生反应:3Cl2+2NH3─→N2+6HCl)的反应。实验时打开开关1、3,关闭2,先向烧瓶中通入,然后关闭1、3,打开2,向烧瓶中慢通入一定量的另一种气体。实验一段时间后烧瓶内出现 浓厚的白烟并在容器内壁凝结,请设计一个实验方案(操作过程、实验现象)鉴定该固体中的阳离子。
Ⅱ.探究某些物质的性质:
(4)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象是;
(5)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。烧瓶F中发生反应的化学方程式为:;装置F中可加入足量NaOH溶液,则其所起的作用是。
为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
【探究一】
(1)常温下,工业上可用铁质容器盛放冷的浓硫酸,其原因是。
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+,产生Fe2+的离子反应方程式为:,检验是否有Fe2+应选用下列(选填序号)试剂。
a.KSCN溶液和氯水b.铁粉和KSCN溶液
c.浓氨水d.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4反应,然后加入足量BaCl2溶液,经正确操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数为。
【探究二】
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893g·L-1。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。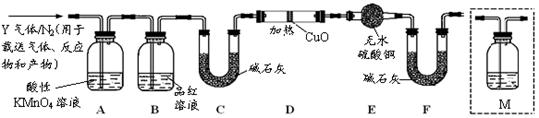
(3)装置B中试剂的作用是
(4)用化学方程式表示Y气体中的Q2气体是如何生成的。
(5)为确认Q2的存在,需在装置中添加洗气瓶M于(选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有Q1,预计实验现象应是。