(12 分)某学生课外兴趣小组对Cl2 与FeCl2 和KSCN 混合溶液的反应进行实验探究。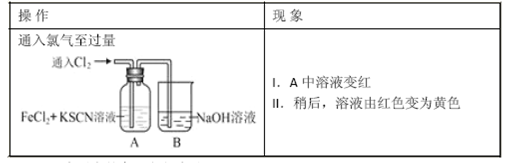
(1)B 中反应的离子方程式是___________________________。
(2)为了探究现象II 的原因,甲同学进行如下实验取A 中黄色溶液于试管中,加入NaOH 溶液,有红褐色沉淀生成,另取A 中黄色溶液于试管中,加入过量的KSCN 溶液,最终得到红色溶液则溶液中一定存在 ,甲同学的实验证明产生现象II 的原因是SCN—与Cl2 发生了反应。
(3)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。资料显示:SCN-的电子式为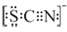 。
。
①甲同学认为SCN-中碳元素没有被氧化,理由是__________。
②取A 中黄色溶液少许于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN- 中被氧化的元素是_________。
③通过下面实验证明了SCN-中氮元素转化为___________________,取足量铜粉于试管中,加入A 中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成。
④若SCN-与Cl2反应生成1 mol CO2,则转移电子的物质的量是___________mol。
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
【探究一】
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是__________________。
(2)另取铁钉6.0 g放入15.0 mL浓硫酸中,加热,充分反应后收集到气体Y。
甲同学取336 mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为______。
【探究二】
分析上述实验中SO2体积分数的结果,乙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
(3)装置B中试剂的作用是_________________________________________。
(4)认为气体Y中还含有Q的理由是______________________________。(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于______(选填序号)。
a.A之前 b.A、B间 c.B、C间 d.C、D间
(6)如果气体Y中含有H2,预计实验现象应是____________________________。
(7)若要测定限定体积气体Y中H2的含量(标准状况下约有28 mL H2),除可用测量H2体积的方法外,可否选用质量称量的方法?做出判断并说明理由________。
某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。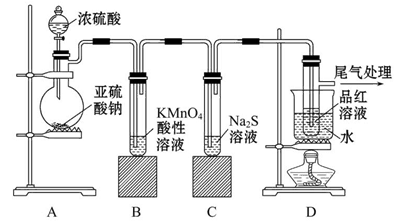
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是__________________,其中发生反应的化学方程式为______________;
(2)实验过程中,装置B、C中产生的现象分别是___________、___________,这些现象分别说明SO2具有的性质是___________和___________;装置B中发生反应的离子方程式为_________________________________________________。
(3)装置D的目的是探究SO2与品红溶液作用的可逆性,请写出实验操作及现象____________;
(4)尾气可采用______________溶液吸收。
二氧化锰与浓盐酸混合加热得到氯气,如图是制取并探究Cl2化学性质的装置图。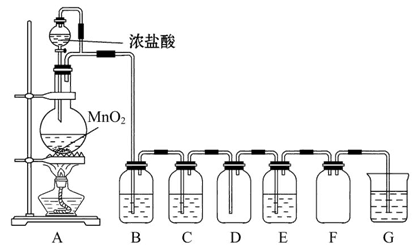
(1)圆底烧瓶中发生反应的化学方程式为________。
(2)若要得到干燥纯净的气体,B、C中应分别盛放的试剂为________、________。
(3)E中若装有FeCl2溶液,反应的离子方程式为________,E中若装有淀粉碘化钾溶液,能观察到的实验现象是______________________________________。
(4)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象某化学兴趣小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通入HCl气体加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸加热
d.MnO2与NaCl的浓溶液混合加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是__________________________________________,
实验c的目的是_________________________________________________。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是____________________________________________。
为了证明一氧化碳具有还原性,有人设计了下列实验: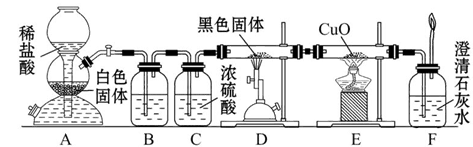
(1)装置B中最适宜的试剂是___________________________________________。
(2)装置D中发生反应的化学方程式是___________________________________。
(3)必须用装置C吸收除去气体中水蒸气的理由是_________________________。
(4)若根据F中石灰水变浑浊的现象也能确定CO具有还原性,应在上图中装置______与______之间连接下列装置中的______(填序号)。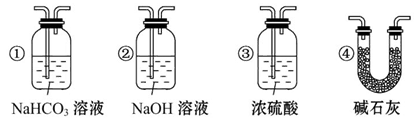
某学习小组设计用如图装置验证二氧化硫的化学性质。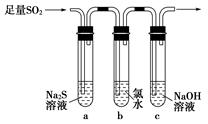
(1)能说明二氧化硫具有氧化性的实验现象为_________________________。
(2)为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案中合理的是________(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为____________________________________________。
(3)当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)=________(用含硫微粒浓度的代数式表示)。